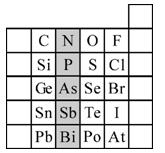
题目内容
用“>”、“=”或“<”表示下列各组多电子原子的原子轨道能量的高低。
(1)2s______2p (2)3px______2py (3)3s_______3d (4)4s______3p
<、>、<、>

(10分)25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(m ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式: ;此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
(3)下图表示此反应的反应速率v和时间t的关系图: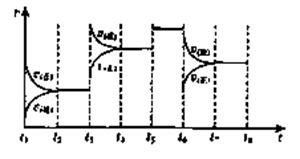
各阶段的平衡常数如下表所示:
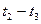 | 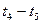 |  |  |
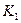 |  | 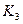 | 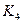 |
(16分)向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.
请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为 。
(2) t4~t5阶段改变的条件为 ,B的起始物质的量浓度为 ,各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为 .
(8分)(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据你掌握的知识判断,下列实验操作的描述中,正确的是 (填字母序号)。
| A.从试剂瓶中取出的药品,若有剩余再放回原试剂瓶 |
| B.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量 |
| C.蒸馏操作时冷凝管进出水的方向是上口进,下口出 |
| D.NaOH溶液不能保存在带有玻璃塞的试剂瓶中 |
F.分液操作所示,分液漏斗中下层液体从下口放出,上层液体上口倒出
(2)化学实验中,不正确的操作会对实验结果的准确性造成一定的影响,请用“>”、“<”或“=”填写下列空白:
①用托盘天平称取8.4g氯化钠,若将砝码和氯化钠的位置放颠倒了,所称取氯化钠的质量 8.4g。
②用容量瓶配制500mL0.1mol·L-1NaOH溶液,定容时仰视刻度线,所得NaOH溶液的物质的量浓度 0.1mol·L-1。
③中和滴定实验时锥形瓶用蒸馏水洗净后未用标准液润洗,则测得锥形瓶中待测液的浓度 实际浓度。