题目内容
6.已知H2O2的分子结构可表示为H-O-O-H,设H2O2中H、O两元素是由${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{8}^{16}$O、${\;}_{8}^{18}$O四种核素组成,则共有H2O2分子的种类是( )| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
分析 H2O2分子可以由${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{8}^{16}$O、${\;}_{8}^{18}$O中的任意四种组成,H元素可以有${\;}_{1}^{1}$H、${\;}_{1}^{1}$H,${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{2}$H、${\;}_{1}^{2}$H三种组合方式,同理O元素可以有${\;}_{8}^{16}$O、${\;}_{8}^{16}$O,${\;}_{8}^{16}$O、${\;}_{8}^{18}$O和${\;}_{8}^{18}$O、${\;}_{8}^{18}$O三种组合方式,结合顺序问题进行解答.
解答 解:根据题意可知,H2O2分子可以由${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{8}^{16}$O、${\;}_{8}^{18}$O中的任意四种组成,H元素可以有${\;}_{1}^{1}$H、${\;}_{1}^{1}$H,${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{2}$H、${\;}_{1}^{2}$H三种组合方式,同理O元素可以有${\;}_{8}^{16}$O、${\;}_{8}^{16}$O,${\;}_{8}^{16}$O、${\;}_{8}^{18}$O和${\;}_{8}^{18}$O、${\;}_{8}^{18}$O三种组合方式,
分别是1-16-16-1,1-16-18-1,1-18-18-1,3种,
1-16-16-2,1-16-18-2,1-18-16-2,1-18-18-2,4种,
2-16-16-2,2-16-18-2,2-18-18-2,3种.
共有3+4+3=10种.
故选:C.
点评 本题考查了同位素的概念,学生也可以利用排列组合的方式解题,该题较为基础,掌握一定的数学知识即可.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案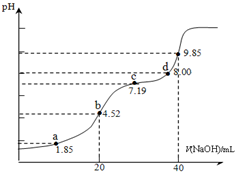 已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)>3c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
| 选项 | 试剂甲 | 试剂乙 | 实验目的 | 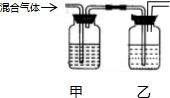 |
| A | NaOH溶液 | 浓硫酸 | 从等体积NO、NH3和NO2中分离出NO | |
| B | KMnO4溶液 | 浓硫酸 | 除去Cl2中的SO2、HCl得干燥Cl2 | |
| C | 溴水 | 浓H2SO4 | 除去乙炔中的H2S和H2O(g) | |
| D | 品红溶液 | 石灰水 | 检验混合气体HCl、SO2、CO2中的SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
(1)a、b、c的化学式分别为Ne、Br2、HF
(2)系列②物质均有氧化性;系列③物质对应水溶液均是强酸
(3)系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
(4)上表内物质HF和H2O,由于氢键的影响,其分子特别稳定.
| A. | 仅有一句 | B. | 两句 | C. | 三句 | D. | 全部正确 |
 .
.
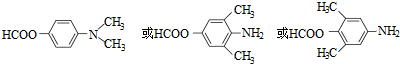 .
.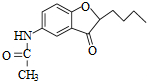 .
.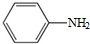 )易被氧化
)易被氧化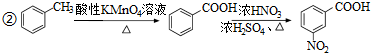
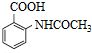 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).