题目内容
某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.将上述物质填入空格,完成该反应,并配平;□ +□ ═□ +□NO+□ .
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中水是反应产物,根据元素守恒知,含有H元素的化合物为反应物,硝酸具有强氧化性,能被还原剂还原为NO,所以硝酸是反应物,硫化氢的还原性大于S,所以硫化氢是反应物,S是生成物,根据得失电子守恒配平方程式.
解答:
解:该反应中水是反应产物,根据元素守恒知,含有H元素的化合物为反应物,HNO3具有强氧化性而作氧化剂,硫化氢的还原性大于S,所以硫化氢作还原剂,则S是还原产物,由得失电子守恒配平方程式为:3H2S+2HNO3=2NO↑+3S+4H2O;
故答案为:3H2S;2HNO3;3S;2;4H2O.
故答案为:3H2S;2HNO3;3S;2;4H2O.
点评:本题考查氧化还原反应,明确物质的性质及元素化合价是解本题关键,知道方程式的配平方法,知道常见元素化合价,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列有关同分异构体数目的叙述中,不正确的是( )
| A、1-氯-1-丙烯可以形成顺反异构 |
B、与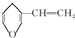 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
C、剧毒物质二恶英,其结构为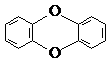 ,已知它的二氯代物有10种同分异构体,则其六氯代物的同分异构体也有10种 ,已知它的二氯代物有10种同分异构体,则其六氯代物的同分异构体也有10种 |
| D、C11H16的苯的同系物中,经分析分子中除苯环外不含其他环状结构,还含有两个-CH3、两个-CH2-、一个-CH-,它的可能结构有4种 |
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图:MFe2Ox
MFe2Oy,则下列判断正确的是( )
| 常温下 |
| SO2 |
| A、MFe2Ox是氧化剂 |
| B、x<y |
| C、SO2是该反应的催化剂 |
| D、SO2发生氧化反应且氧化性:MFe2Oy>SO2 |
下列各项与反应热的大小无关的是( )
| A、反应物和生成物的状态 |
| B、反应物量的多少 |
| C、反应物的性质 |
| D、反应热的单位 |
下列过程放出热量的是(1)铝放入盐酸中(2)水蒸气变成掖态水(3)氧分子变成氧原子(4)煅烧石灰石生成生石灰和二氧化碳( )
| A、(1)(2) |
| B、(3)(4) |
| C、(1)(3) |
| D、(2)(4) |
下列微粒中,只有氧化性的是( )
①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg.
①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg.
| A、①⑦ | B、②④ |
| C、③⑤⑥ | D、②④⑤⑥ |
某物质熔融状态可导电,固态可导电,将其投入水中溶液也可导电,推测该物质可能是( )
| A、金属 | B、非金属 |
| C、可溶性碱 | D、可溶性盐 |
下列电离方程式错误的是( )
| A、K2CO3═2K++CO32- |
| B、NaHSO4═H++SO42-+Na+ |
| C、KHCO3═K++H++CO32- |
| D、NH4Cl═NH4++Cl- |
下列说法错误的是( )
A、用数轴表示分散系的分类: |
| B、已知氯酸钾与蔗糖(C12H22O11)反应的产物为KCl、CO2和水,则氧化产物与还原产物的物质的量之比为2:3 |
| C、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| D、可以用Ba(OH)2和焰色反应鉴别NaHCO3、NaCl、KCl、K2SO4 |