题目内容
19.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA | |
| B. | 3.4g NH3中含原子总数目为0.6NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| D. | 23gNO2和N2O4的混合气体中含有原子总数1.5NA |
分析 A、铁与盐酸反应后变为+2价;
B、求出氨气的物质的量,然后根据1mol氨气中含4mol原子来分析;
C、气体所处的状态不明确;
D、NO2和N2O4的最简式均为NO2.
解答 解:A、铁与盐酸反应后变为+2价,故0.1mol铁与盐酸反应后失去0.2mol电子即0.2NA个,故A错误;
B、3.4g氨气的物质的量n=$\frac{3.4g}{17g/mol}$=0.2mol,而1mol氨气中含4mol原子,故0.2mol氨气中含0.8mol原子即0.8NA个,故B错误;
C、气体所处的状态不明确,不一定是标况,故气体的体积不一定是22.4L,故C错误;
D、NO2和N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量n=$\frac{23g}{46g/mol}$=0.5mol,而1molNO2中含3mol原子,故0.5molNO2中含1.5mol即1.5NA个原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
10.为了使FeSO4氧化成Fe2(SO4)3而又不引入杂质,应向悬浊液中加入( )
| A. | Cl2 | B. | HNO3 | C. | H2O2 | D. | Na2O2 |
11.下列化合物中,不能由两种单质直接化合制得的是( )
| A. | FeS | B. | FeCl3 | C. | Fe3O4 | D. | FeCl2 |
7.下列实验装置能达到实验目的是( )
| A. |  石油分馏 | B. |  比较非金属性:Cl>C>Si | ||
| C. |  形成原电池 | D. |  铝热反应 |
4.下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合化学和生物学科的知识,回答下列问题.
(1)要在食盐中加碘,是因为碘是人体内合成甲状腺激素的主要原料,缺碘会引起疾病.
(2)食盐中加碘,这碘指的是元素(填“单质”、“化合物”或“元素”),其中碘元素的化合价为+5.
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
(2)食盐中加碘,这碘指的是元素(填“单质”、“化合物”或“元素”),其中碘元素的化合价为+5.
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
11.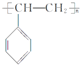 生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
 生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |
8.根据有机化合物的命名原则,下列命名正确的是( )
| A. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. |  2-羟基丁烷 2-羟基丁烷 | ||
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空: