题目内容
7.下列实验装置能达到实验目的是( )| A. |  石油分馏 | B. |  比较非金属性:Cl>C>Si | ||
| C. |  形成原电池 | D. |  铝热反应 |
分析 A.温度计应测定馏分的温度;
B.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与硅酸钠反应;
C.酒精为非电解质;
D.点燃镁条引发铝热反应,发生Al与氧化铁的氧化还原反应.
解答 解:A.温度计应测定馏分的温度,图中温度计的水银球应在烧瓶支管口处,故A错误;
B.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与硅酸钠反应,则不能比较碳酸与硅酸的酸性,且不能利用盐酸与碳酸的酸性比较非金属性,即不能比较非金属性,故B错误;
C.酒精为非电解质,不导电,不能构成原电池,故C错误;
D.点燃镁条引发铝热反应,发生Al与氧化铁的氧化还原反应,图中装置及试剂均合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯实验、非金属性比较、原电池及铝热反应等,把握实验原理、发生的反应及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
19.下列说法中正确的是( )
| A. | 人们已知道了107种元素,即已经知道了107种原子 | |
| B. | 互为同位素的原子,它们原子核内的中子数一定不相等 | |
| C. | 40K和40Ca原子中的中子数相等 | |
| D. | 质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同 |
2.关于中和反应反应热测定的实验,下列说法不正确是( )
| A. | 不可以用铜丝搅拌棒代替环形玻璃搅拌棒 | |
| B. | 用稍过量的NaOH溶液保证盐酸完全被中和 | |
| C. | 使用环形玻璃搅拌棒是为了加快反应速率,减小实验误差 | |
| D. | 用0.5 mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 |
12.如图是元素周期表的一部分,下列说法中正确的是( )
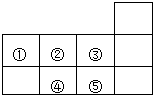

| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 元素的最高正化合价:③=⑤ | D. | 最高价氧化物对应水化物酸性:⑤>④ |
19.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA | |
| B. | 3.4g NH3中含原子总数目为0.6NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| D. | 23gNO2和N2O4的混合气体中含有原子总数1.5NA |
16.下列关于物质的检验说法正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| B. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- | |
| C. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| D. | 用四氯化碳萃取某溶液时,分层且下层显紫红色,可能存在碘单质 |
17.“纳米材料”是当今材料科学的前沿.所谓“纳米材料”是指研究开发出的直径在几纳米到几十纳米之间的材料.若将纳米材料分散到分散剂中,所形成的混合物可能具有的性质是( )
| A. | 能全部透过半透膜 | B. | 有丁达尔现象 | ||
| C. | 不能全部透过滤纸 | D. | 所得物质一定是悬浊液 |

 ,写出它的一种用途做溶剂、灭火剂等.
,写出它的一种用途做溶剂、灭火剂等.