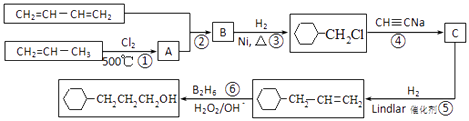
题目内容
【题目】二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2 , 若充有10molCO发生反应:CO(g)+2H2(g)CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(CO)/mol | 10 | 7 | 5 | 5 |
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=mol/(Lmin);
(2)你认为p1p2(填“<”“>”或“=”)
(3)合成甲醇的反应为(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为 .
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有 .
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为: .
【答案】
(1)0.6
(2)<
(3)放热;Ka=Kb>Kc
(4)①③④⑤⑥
(5)2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol
【解析】解:(1)p2、T2时,0~lmin 内,CO的转化率是0.5,则参加反应的n(CO)=(10﹣7)mol=3mol,则v(CO)= ![]() =0.3mol/(L.min),根据反应速率之比等于计量数之比计算ν(H2)=2v(CO)=2×0.3mol/(L.min)=0.6mol/(L.min),
=0.3mol/(L.min),根据反应速率之比等于计量数之比计算ν(H2)=2v(CO)=2×0.3mol/(L.min)=0.6mol/(L.min),
所以答案是:0.6;(2)相同温度下,该反应的正反应是反应前后气体体积减小的可逆反应,增大压强平衡正向移动,CO的转化率增大,根据图知,相同温度下CO的转化率P1<P2 , 所以答案是:<; (3)升高温度,CO的转化率降低,说明平衡逆向移动,则正反应是放热反应,所以△H<0,
该反应的正反应是放热反应,升高温度平衡常数减小,AB温度相同且小于C,所以平衡常数Ka=Kb>Kc ,
所以答案是:放热;Ka=Kb>Kc;(4)能增加单位时间内CH3OH产量,说明增大正逆反应速率,可以通过增大反应物浓度、减小生成物浓度、升高温度、加入催化剂、增大压强等方法实现,
故选①③④⑤⑥;(5)碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g)△H=﹣Q1kJ/mol ①
碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,其热化学方程式为C(s)+ ![]() O2(g)=CO(g)△H=﹣Q2kJ/mol ②
O2(g)=CO(g)△H=﹣Q2kJ/mol ②
将方程式2(②﹣①)得2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol,
所以答案是:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】下表是周期表中的一部分,根据A﹣I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(6)小题按题目要求回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物中碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的
(4)在B,C,E,F,G,H中,原子半径最大的是
(5)A和D组成化合物的电子式
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式 .