题目内容
9. 能量之间可以相互转化:原电池可将化学能转化为电能.
能量之间可以相互转化:原电池可将化学能转化为电能.(1)下列反应能设计成原电池的是:③.
①NaOH+HCl═NaC1+H2O
②AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl
③2FeCl3+Fe═3FeCl2.
(2)根据(1)中所选的反应设计成原电池如图,请在图中完成并作相应标注,标出电极材料及电解质溶液.写出该电池的正极反应式:Fe3++e-=Fe2+,电池工作的时候,盐桥中的阴离子移向负极(填“负极”,“正极”或“不移动”).
分析 (1)能设计成原电池的反应必须是自发进行的放热的氧化还原反应;
(2)将2FeCl3+Fe═3FeCl2设计成原电池反应,则Fe为负极,正极可为碳棒等,负极电解质溶液为FeCl2,正极电解质溶液为FeCl3.
解答 解:(1)能设计成原电池的反应应是能自发进行的氧化还原反应,①为中和反应,②为复分解反应,③为氧化还原反应,且反应放热,可设计成原电池,
根据分析可知,①②不属于氧化还原反应,无法设计成原电池,只有③满足条件,
故答案为:③;
(2)由方程式Fe+2FeCl3=3FeCl2可知,Fe被氧化,为原电池的负极,负极反应为:Fe-2e-=Fe2+,正极Fe3+被还原,电极方程式为:2Fe3++2e-=2Fe2+,负极电解质溶液为FeCl2,正极电解质溶液为FeCl3,原电池工作时,盐桥中的阴离子向负极移动,装置图为: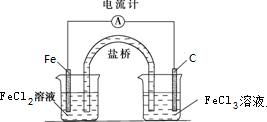 ,
,
故答案为: ;Fe3++e-=Fe2+;负极.
;Fe3++e-=Fe2+;负极.
点评 本题考查原电池的设计,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,题目难度中等,明确原电池的构成条件及反应必须是放热反应是解本题的关键,注意掌握原电池工作原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.2015年巴黎气候变化大会的主题之一是节能减排,开发新能源以及提高能源的利用率再次受到国际社会的高度关注.
(1)近年我国努力调整能源结构,开发新能源.下列物质中,属于可再生能源的是A(填字母).
A、氢能 B、天然气 C、石油
(2)已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-l
2C(s)+O2(g)=2COg)△H=-221.0kJ•mol-l
2CO(g)+O2(g)=2CO(g)△H=-556.0kJ•mol-l
请回答下列问题:
①l g H2(g)在氧气中完全燃烧生成H2O(g)时放出的热量为120.9kJ.氢气被称为绿色能源的主要原因是燃烧产物是水,无污染.
②若18g C(s)氧气中不完全燃烧,生成的CO(g)与CO2(g)的物质的量之比为2:l,
则该过程放出的热量比等质量的C(s)在氧气中完全燃烧时要少278kJ.
③将煤转化为水煤气(H2、CO的混合气)是将煤转化为清洁燃料的方法之一.
则C(s)与H2O (g)反应制备水煤气的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol.
(3)工业上可通过CO(g)和H2(g)化合来制备可再生能源CH3OH(g):
CO(g)+2H2(g)=CH3OH(g)△H=-99kJ•mol-l
又知该反应中某些物质分子里的化学键的键能数据如下表:
如CO中的C与O之间为叁键连接,则C≡O键的键能为1076kJ•mol-l.
(1)近年我国努力调整能源结构,开发新能源.下列物质中,属于可再生能源的是A(填字母).
A、氢能 B、天然气 C、石油
(2)已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-l
2C(s)+O2(g)=2COg)△H=-221.0kJ•mol-l
2CO(g)+O2(g)=2CO(g)△H=-556.0kJ•mol-l
请回答下列问题:
①l g H2(g)在氧气中完全燃烧生成H2O(g)时放出的热量为120.9kJ.氢气被称为绿色能源的主要原因是燃烧产物是水,无污染.
②若18g C(s)氧气中不完全燃烧,生成的CO(g)与CO2(g)的物质的量之比为2:l,
则该过程放出的热量比等质量的C(s)在氧气中完全燃烧时要少278kJ.
③将煤转化为水煤气(H2、CO的混合气)是将煤转化为清洁燃料的方法之一.
则C(s)与H2O (g)反应制备水煤气的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol.
(3)工业上可通过CO(g)和H2(g)化合来制备可再生能源CH3OH(g):
CO(g)+2H2(g)=CH3OH(g)△H=-99kJ•mol-l
又知该反应中某些物质分子里的化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-l | 413 | 436 | 343 | 465 |
6.下列化合物与小苏打溶液反应,没有气体或沉淀生成的是( )
| A. | NaOH | B. | HCl | C. | Ca(OH)2 | D. | Na2O2 |
3.下列物质所含分子数最多的是( )
| A. | 36克水 | B. | 标准状况下的22.4升CO | ||
| C. | 含有7克N的HNO3 | D. | 常态下,500毫升0.5摩/升的盐酸 |
14.下列实验装置科学合理的是( )
| A. |  实验室制取少量Cl2 | B. |  硝基苯的制取 | ||
| C. |  CO还原氧化铁并尾气吸收 | D. |  乙酸乙酯制备 |
18.下列物质间不能发生离子反应的是( )
| A. | Na2SO4溶液与BaCl2溶液 | B. | 铝片插入Hg(NO3)2溶液 | ||
| C. | NaNO3溶液与KCl溶液 | D. | Na2CO3溶液与稀盐酸 |
19.下列离子方程式正确的是( )
| A. | 铁屑溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| B. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | NaOH溶液中滴加少量Al2(SO4)3溶液:Al3++3OH-═Al(OH)3↓ |