题目内容
1.萘( )是最简单的稠环芳香烃.下列关于萘的说法中正确的是( )
)是最简单的稠环芳香烃.下列关于萘的说法中正确的是( )| A. | 萘与足量氢气充分加成的产物一氯代物有2种 | |
| B. | 1mol萘最多可与6mol H2加成 | |
| C. | 萘的一氯代物有2种,二氯代物有10种 | |
| D. | 萘属于苯的同系物 |
分析 萘中含稠环,与足量氢气充分加成的产物为 ,由结构对称性可知,含3种位置的H,如图
,由结构对称性可知,含3种位置的H,如图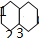 ,二卤代物由一卤定位,另一个卤原子转位分析,以此来解答.
,二卤代物由一卤定位,另一个卤原子转位分析,以此来解答.
解答 解:A.与足量氢气充分加成的产物为 ,含3种位置的H,一氯代物有3种,故A错误;
,含3种位置的H,一氯代物有3种,故A错误;
B.由 →
→ ,需要10个H原子,则1mol萘最多可与5mol H2加成,故B错误;
,需要10个H原子,则1mol萘最多可与5mol H2加成,故B错误;
C.由结构对称可知,萘中含2种位置的H,则其一氯代物有2种( ),二氯代物有10种(
),二氯代物有10种( ),故C正确;
),故C正确;
D.苯中只有1个苯环,与萘中含稠环,结构不同,不是同系物,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构对称性为解答的关键,选项C为解答的难点,注意二卤代物的推断,题目难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
12.已知分子式为C12H12的物质A结构简式如图,苯环上的一溴代物有( )
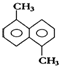

| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
9.将甲、乙两种金属的性质相比较,
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ①②③④⑤ |
16.三联苯 的一氯代物有( ) 种同分异构体.
的一氯代物有( ) 种同分异构体.
 的一氯代物有( ) 种同分异构体.
的一氯代物有( ) 种同分异构体.| A. | 3 | B. | 4 | C. | 2 | D. | 5 |
6.下列说法正确的是( )
| A. | 第IA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 | |
| B. | 第二周期元素的最高正价和最低负价的绝对值之和等于8 | |
| C. | 同周期主族元素的原子形成简单离子的电子层结构相同 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
13.下列关于化学键的叙述,正确的是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有金属元素的物质中均存在离子键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
10.已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 mol•L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
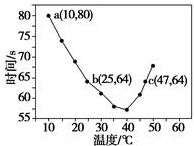

| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |