题目内容
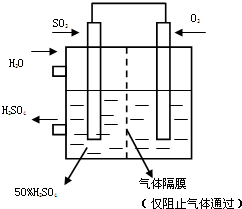
如图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )

| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是:SO2+2H2O-2e-=SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15 |

A.该装置没有外加电源,是一个原电池,把化学能转化为电能,故A正确;
B.催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱,故B错误;
C.催化剂a表面是SO2失去电子生成硫酸,电极方程为:SO2+2H2O-2e-=SO42-+4H+,故C正确;
D.催化剂a处的反应为:SO2+2H2O-2e-=SO42-+4H+,
催化剂b处的反应为:
O2+2H++2e-=H2O
总方程为:SO2+H2O+
O2=H2SO4
设加入的SO2为xg,H2O为yg.
则生成硫酸的质量为:
水的质量变化为:y-
根据二者的比值为49%,可以求得
=
,故D正确;
故选B.
B.催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱,故B错误;
C.催化剂a表面是SO2失去电子生成硫酸,电极方程为:SO2+2H2O-2e-=SO42-+4H+,故C正确;
D.催化剂a处的反应为:SO2+2H2O-2e-=SO42-+4H+,
催化剂b处的反应为:
| 1 |
| 2 |
总方程为:SO2+H2O+
| 1 |
| 2 |
设加入的SO2为xg,H2O为yg.
则生成硫酸的质量为:
| xg×98g/mol |
| 64g/mol |
水的质量变化为:y-
| xg×18g/mol |
| 64g/mol |
根据二者的比值为49%,可以求得
| x |
| y |
| 8 |
| 15 |
故选B.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
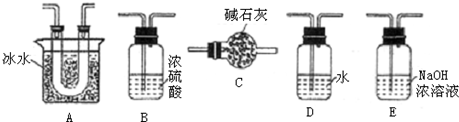
用如图装置进行SO2转化为SO3的转化率测定实验: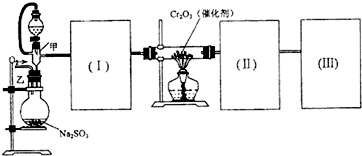
2SO2+O2
2SO3;△H=-196kJ/mol.已知:
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内.Ⅰ 、Ⅱ 、Ⅲ
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) .
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起的作用是 .解释实验室要用75%的浓硫酸而不用稀硫酸制备SO2的原因
(4)开始实验时,先从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 .
(5)实验中“当Cr2O3表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为 %(保留小数点后一位).


2SO2+O2
| Cl2O2 |
| 熔点(℃) | 沸点(℃) | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起的作用是
(4)开始实验时,先从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是
(5)实验中“当Cr2O3表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为

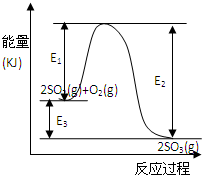 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.