题目内容
某原电池结构如图所示,下列有关该原电池的说法正确的是( )


| A、能将电能转换成化学能 |
| B、碳棒发生氧化反应 |
| C、该装置中发生的反应为:Cu+2Fe3+═2Fe2++Cu2+ |
| D、电子从碳棒经外电路流向铜棒 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:因铜与铁离子可发生Cu+2Fe3+═2Fe2++Cu2+,形成原电池时,铜为负极被氧化,C为正极,Fe3+被还原生成Fe2+,电子从负极经外电路流向正极,以此解答该题.
解答:
解:A.该装置为原电池装置,可将化学能转化为电能,故A错误;
B.碳棒为正极,发生还原反应,故B错误;
C.负极是铜失电子发生氧化反应,电极反应为Cu-2e-=Cu2+,正极反应为Fe3++e-=Fe2+,总反应为Cu+2Fe3+═2Fe2++Cu2+,故C正确;
D.电子从负极经外电路流向正极,故D错误.
故选C.
B.碳棒为正极,发生还原反应,故B错误;
C.负极是铜失电子发生氧化反应,电极反应为Cu-2e-=Cu2+,正极反应为Fe3++e-=Fe2+,总反应为Cu+2Fe3+═2Fe2++Cu2+,故C正确;
D.电子从负极经外电路流向正极,故D错误.
故选C.
点评:本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的组成条件、工作原理以及电极方程式的书写,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
下列关于电解的说法正确的是( )
| A、阳极上发生氧化反应 |
| B、阴极上发生氧化反应 |
| C、电解饱和食盐水制烧碱时,用铜作阳极 |
| D、电解法精炼铜时,粗铜作阳极 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48gO3和48gO2含有的氧原子数均为3NA |
| B、1.8g的NH4+离子中含有的电子数为0.1NA |
| C、11.2L氧气中所含有的原子数为NA |
| D、标准状况下,22.4 L水所含分子数为NA |
下列措施不符合“绿色化学”思想的是( )
| A、循环使用物料 |
| B、用水代替有机溶剂 |
| C、直接排放电镀废水 |
| D、发展原子利用率达到100%的化学反应 |

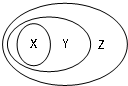 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )
