题目内容
18.写出下列物质的电离方程式:(1)H2SO4H2SO4=2H++SO42-;(2)Cu(NO3)2Cu(NO3)2=Cu2++2NO3-;(3)Na2CO3Na2CO3=2Na++CO32-;(4)CaCl2CaCl2=Ca2++2Cl-.
分析 书写电离方程式应先判断电解质的强弱,强电解质完全电离,用等号,弱电解质部分电离,用可逆号,据此解答.
解答 解:(1)H2SO4是强酸,属于强电解质,电离方程式为:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(2)Cu(NO3)2是盐,属于强电解质,电离方程式为:Cu(NO3)2=Cu2++2NO3-,
故答案为:Cu(NO3)2=Cu2++2NO3-;
(3)碳酸钠是盐,属于强电解质,电离方程式为:Na2CO3=2Na++CO32-,
故答案为:Na2CO3=2Na++CO32-;
(4)CaCl2是盐,属于强电解质,电离方程式为:CaCl2=Ca2++2Cl-,
故答案为:CaCl2=Ca2++2Cl-.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱是解题关键,注意弱电解质用可逆号,强电解质用等号.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
6.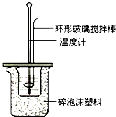 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):a b e.
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):a b e.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写下表中的空白:
 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
13.下列物质所含原子数目最多的是( )
| A. | 0.3molSO3 | B. | 66gCO2 | C. | 1.204×1023个NH3 | D. | 4℃时18mLH2O. |
10.下列变化的实质相似的是( )
| A. | 浓H2SO4和浓HCl在空气中敞口放置时浓度均减小 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀硫酸与锌反应均生成气体 | |
| D. | 浓H2SO4、浓HNO3均可以用铁制容器贮存 |
7.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.下列说法不正确的是( )
| A. | 1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量 | |
| B. | 形成2 mol NH3(g)的化学键释放的总能量大于断裂1 mol N2 (g) 和3 mol H2 (g) 的化学键所吸收的总能量 | |
| C. | 加入催化剂是为了加大反应速率,缩短生产周期,降低生产成本 | |
| D. | 将1 mol N2(g)和3 mol H2(g)充入一密闭容器中充分反应,放出92.2 kJ 的热量 |
8.在下列反应中,盐酸作氧化剂的是( )
| A. | NaOH+HCl=NaCl+H2O | |
| B. | Zn+2HCl=ZnCl2+H2 | |
| C. | BaCO3+2HCl=BaCl2+H2O+CO2↑ | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O |
 氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下: 茉莉酮是一种人工合成的香料,其结构简式如图所示:
茉莉酮是一种人工合成的香料,其结构简式如图所示: