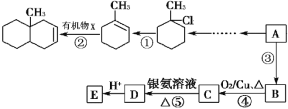
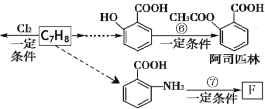
题目内容
【题目】
(1)氨气是化学实验室常需制取的气体。实验室制取氨气通常有两种方法:
方法一 固体氢氧化钙与氯化铵共热
方法二 固体氢氧化钠与浓氨水反应
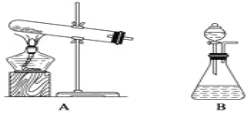
①下面的制取装置图中,方法一应选用装置________(填“A”或“B”,下同),方法二应选用装置________。
②写出加热NH4Cl和Ca(OH)2制取NH3的反应方程式:
________________________________________________________________________。
③在制取后,如果要干燥氨气,应选用的干燥剂是________,收集氨气的方法是
A.浓硫酸
B.碱石灰
C.五氧化二磷
D.向上排空气法
E.排水法
F.向下排空气法
④检验是否收集满氨气的方法是____________________________________
(2)请观察如图装置,回答下列问题:
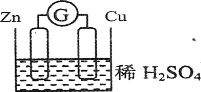
①负极是 ,发生 反应(填氧化或还原)
②正极的电极反应式:
③该装置是一种把 的装置,当导线中有0.2 mol e-发生转移时,求参加氧化反应的物质的物质的量为
【答案】(1)①A ;B
②2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
③B; F
④用湿润的红色石蕊试纸放在试管口,看试纸是否变蓝,变蓝则收集满(正确都得分)
(2)① Zn;氧化
②2H+ +2e-= H2↑
③化学能转变为电能;0.1mol
【解析】
试题分析:①方法一:实验室用氯化铵和氢氧化钙在加热条件下制备氨气,利用固体+固体加热制备气体选择气体发生装置为A;方法二:实验室用固体氢氧化钠与浓氨水反应制取氨气,利用固体+液体不加热制备气体选择气体发生装置为B。
故答案为:A;B
②实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
③由于氨气属于碱性气体,所以在制取后如果要干燥氨气,应选用碱性干燥剂碱石灰,即选B;氨气极易溶解于水且密度比空气小,所以收集氨气的方法是向下排空气法,即选F。
故答案为:B;F;
④氨气为碱性气体,与水反应生成NH3H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气,或用湿润的红色石蕊试纸靠近试管口,如果 试纸变蓝,则证明是氨气氨气。
故答案为:用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气;或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则证明是氨气。
(2)①电极材料为Cu和Zn,Zn较活泼,作原电池的负极,失去电子而被氧化,故答案为:Zn;氧化;
②C为该原电池的正极,正极上发生还原反应,电极反应式为:2H++2e-=H2↑。
故答案为:2H++2e-=H2↑;
③该装置是一种把化学能转变为电能的装置,属于原电池装置;该原电池工作时,正极反应为2H++2e-=H2↑,负极反应为Zn-2e-=Zn2+,所以当导线中有0.2mole-发生转移时,求参加氧化反应的Zn的物质的量为0.1mol。
故答案为:化学能转变为电能;0.1mol。