题目内容
17.在标准状况下,将aLNH3完全溶于1L水得到VmL氨水,溶液的密度为ρg?cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L.下列叙述中正确的是①ω=$\frac{35a}{22.4Vρ}$×100%②c=$\frac{1000a}{22.4V}$③c=$\frac{1000aρ}{22400+17a}$④ω=$\frac{17c}{1000ρ}$⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω( )
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | ②③⑤ |
分析 ①根据ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算;
②根据c=$\frac{n}{V}$计算溶质的物质的量浓度;
③计算出溶液质量,然后计算出溶液体积,再根据c=$\frac{n}{V}$计算溶质的物质的量浓度;
④根据c=$\frac{1000ρω}{M}$进行计算;
⑤水的密度大于氨水的密度,所以等体积时,水的质量大于氨水的质量,这样混合后,所得溶液浓度小于0.5ω.
解答 解:①氨气溶于水,主要以NH3•H2O存在,但仍然以NH3作为溶质,ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%=$\frac{\frac{aL}{22.4L/mol}×17g/mol}{ρ{V}_{溶液}}$=$\frac{17a}{22.4ρV}$×100%,故①错误;
②该溶液的浓度c=$\frac{\frac{aL}{22.4L/mol}}{V×1{0}^{-3}L}$=$\frac{1000a}{22.4V}$mol/L,故B正确;
③该溶液的质量为:1000g+$\frac{aL}{22.4L/mol}$×17g/mol,该溶液的体积为:$\frac{1000g+\frac{17a}{22.4}g}{1000ρg/L}$=$\frac{22400+17a}{22400ρ}$L,所得溶液浓度为:c=$\frac{\frac{aL}{22.4L/mol}}{\frac{22400+17a}{22400ρ}}$=$\frac{1000aρ}{22400+17a}$,故③正确;
④根据c=$\frac{1000ρω}{M}$可得:ω=$\frac{17c}{1000ρ}$,故④正确;
⑤氨水的密度小于水,混合过程中溶质的质量不变,溶液的质量大于原先的2倍,则所得溶液的质量分数小于原先的一半,即小于0.5ω,故⑤错误;
故选B.
点评 本题考查了物质的量浓度的有关计算,题目难度中等,有一定的难度,明确密度比水小的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数小于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半),如氨水、酒精溶液.

 某有机物结构如图所示,一分子该物质与一分子溴发生加成反应的产物(不考虑顺反异构)理该上最多有( )
某有机物结构如图所示,一分子该物质与一分子溴发生加成反应的产物(不考虑顺反异构)理该上最多有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |

| A. | ③④ | B. | ②⑤ | C. | ①③④ | D. | ②③④⑤ |
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
| A. | 乙醇与丙三醇 | B. | C6H5OH与C6H5CH2OH | ||
| C. | 重氢与超重氢 | D. | 新戊烷与正丁烷 |
| A. | 属于置换反应 | B. | H-是氧化剂 | ||
| C. | NH3是还原剂 | D. | 氧化产物和还原产物都是H2 |
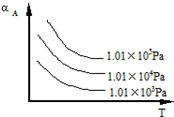 在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示:
在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示: