题目内容
6.为了探究镁与水反应的情况,甲乙丙三位同学分别做了如下实验,并得出了结论.甲同学:取一段镁条放入盛有水的试管中,未见明显反应现象;加热,仍未见明显反应现象,再向试管中滴加酚酞,试管中试液仍无色.结论:镁与冷水、热水都不反应.
乙同学:取一段镁,首先用砂纸擦去氯化膜后放入盛有水的试管中,未见明显变化;加热,镁条表面出现气泡,但未见镁条溶解,向试管中滴加酚酞,溶液显红色.结论:镁与冷水不反应,镁与热水可反应产生碱,但由于Mg(OH)2难溶,所以镁条不能完全溶解.
丙同学:取一段镁条,用砂纸擦去氧化膜后放入盛有滴加酚酞的水的试管中,未见明显变人;加热,镁条表面现少量气泡,溶液逐渐变红,但未见镁条溶解.结论:与乙同学相同.
你认为甲、乙、丙同学的做法与结论是否正确?为什么?
分析 Mg极易被空气中氧气氧化生成致密的氧化物薄膜MgO,MgO和水不反应,所以要检验Mg是否和水反应,应该先除去表面的MgO薄膜,做Mg和冷水、热水反应对比实验时,要根据有明显变化现象分析判断,据此分析解答.
解答 解:Mg极易被空气中氧气氧化生成致密的氧化物薄膜MgO,MgO和水不反应,所以要检验Mg是否和水反应,应该先除去表面的MgO薄膜,做Mg和冷水、热水反应对比实验时,要根据有明显变化现象分析判断;
甲同学不正确,因为他未除去镁条表面的氧化膜,没有让水与金属镁接触,故不能说明镁与水不反应;
乙同学操作不合理,由于镁与水反应生成碱的现象不够明显,故判断镁与冷水不反应时也应加酚酞试液,若加热后加酚酞试液,液体变红,不能说明镁与冷水不反应;
丙同学的做法和结论是正确的;
故答案为:甲同学不正确,因为他未除去镁条表面的氧化膜,没有让水与金属镁接触,故不能说明镁与水不反应;
乙同学操作不合理,由于镁与水反应生成碱的现象不够明显,故判断镁与冷水不反应时也应加酚酞试液,若加热后加酚酞试液,液体变红,不能说明镁与冷水不反应;
丙同学的做法和结论是正确的.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断及实验设计、操作能力,注意排除其它因素的干扰,题目难度中等.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
16. 学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-.
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.在答题卡上补充填写出实验步骤、预期现象和结论.
限选试剂及仪器:2mol/LHCl、2mol/LHNO3、1mol/LBaCl2溶液、lmol/LBa(NO3)2溶液、0.1mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管.
(3)为准确测定通入氯气一段时间后剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:取洗气瓶C中全部溶液准确配制250mL溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.1980mol/LKMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算250mL溶液中FeCl2的物质的量=$\frac{250}{25.00}$×0.1980×V×10-3×5或10×0.1980×V×10-3×5mol(只列出算式,不做运算).
 学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-.
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.在答题卡上补充填写出实验步骤、预期现象和结论.
限选试剂及仪器:2mol/LHCl、2mol/LHNO3、1mol/LBaCl2溶液、lmol/LBa(NO3)2溶液、0.1mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加滴加过量2mol/LHCl(1分)和1mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子. |
①配制250mL 溶液:取洗气瓶C中全部溶液准确配制250mL溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.1980mol/LKMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算250mL溶液中FeCl2的物质的量=$\frac{250}{25.00}$×0.1980×V×10-3×5或10×0.1980×V×10-3×5mol(只列出算式,不做运算).
17.有下列几种有机物:①CH3COOCH3②CH2=CHCH2Cl③苯乙烯④2-甲基丙烯酸甲酯⑤CH2=CCl-CHO.其中既能发生水解反应,又能发生加聚反应的是( )
| A. | ①与④ | B. | ②与⑤ | C. | ②与④ | D. | ①、③和④ |
14.下列说法中错误的是( )
| A. | 二氧化硫是非电解质 | |
| B. | 氢离子浓度相同的盐酸和醋酸导电能力相同 | |
| C. | 庆阳化铁胶体能导电,故氢氧化铁胶体是电解质 | |
| D. | 在相同温度下,饱和溶液不一定比不饱和溶液的导电性强 |
11.一定质量的某种有机物和足量金属钠反应,得到VA L气体,相同质量的该有机物与足量Na2CO3溶液反应,可得VB L气体,已知同温同压下VA≠VB.则该有机物可能是( )
| A. | CH3CH(OH)COOH | B. |  | ||
| C. | CH3CH2COOH | D. | HOOC-COOH |
18.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加酚酞呈红色的溶液:I-,ClO-,NO3-,Na+ | |
| B. | 含有Fe3+的溶液:K+,Mg2+,SCN-,HSO3- | |
| C. | $\frac{Kw}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+,K+,SiO32-,Br- | |
| D. | 加Al能生成H2的溶液:Na+,K+,CO32-,Cl- |
15.下列实验操作正确的是( )
| A. | 将氯气溶于水,须通入倒置并边缘没入水中的漏斗 | |
| B. | 粉碎结块的硝酸铵,可将药品放入研体中轻轻敲碎 | |
| C. | 洗涤做过银镜反应的试管,先用浓硝酸洗涤,再用自来水冲洗 | |
| D. | 玻璃导管与橡皮导管连接,可使玻璃导管蘸水后边旋转边插入橡皮导管 |
2.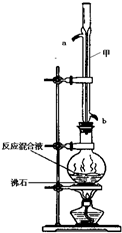 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率或苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%(结果保留三位有效数字).
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出.
 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率或苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%(结果保留三位有效数字).
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出.