题目内容
3.现有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Ba2+、CO32-、Cl-、SO42-.现取两份200mL溶液分别进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
则①溶液中一定存在K+、NH4+、CO32-、SO42-;一定不存在Ba2+.
②溶液中n(K+)≥0.04mol.
分析 一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Ba2+、CO32-、Cl-、SO42-;
现取两份200mL溶液分别进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.36g,收集到的气体是氨气,n(NH3)=$\frac{1.36g}{17g/mol}$=0.08mol;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,说明部分沉淀能溶于稀盐酸,所以生成的沉淀有BaCO3、BaSO4,能溶于稀盐酸的是BaCO3、不能溶于稀盐酸的是BaSO4,n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,n(BaCO3)=$\frac{12.54g-4.66g}{197g/mol}$=0.04mol,
根据电荷守恒知硫酸根离子、碳酸根离子所带电荷之和大于铵根离子,所以溶液中还含有钾离子,据离子共存知,溶液中一定不存在Ba2+,
不能确定是否含有氯离子,
据此分析解答.
解答 解:一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Ba2+、CO32-、Cl-、SO42-;
现取两份200mL溶液分别进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.36g,收集到的气体是氨气,n(NH3)=$\frac{1.36g}{17g/mol}$=0.08mol;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,说明部分沉淀能溶于稀盐酸,所以生成的沉淀有BaCO3、BaSO4,能溶于稀盐酸的是BaCO3、不能溶于稀盐酸的是BaSO4,n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,n(BaCO3)=$\frac{12.54g-4.66g}{197g/mol}$=0.04mol,
根据电荷守恒知硫酸根离子、碳酸根离子所带电荷之和大于铵根离子,所以溶液中还含有钾离子,据离子共存知,溶液中一定不存在Ba2+,
不能确定是否含有氯离子,
①通过以上分析知,一定含有的离子有K+、NH4+、CO32-、SO42-,一定不含的离子有Ba2+,故答案为:K+、NH4+、CO32-、SO42-;Ba2+;
②如果溶液中不含氯离子,则钾离子物质的量最少,根据电荷守恒得n(K+)=2n(CO32-)+2n(SO42-)-n(NH4+)=
2×0.04mol+2×0.02mol-0.08mol=0.04mol,所以n(K+)≥0.04mol,
故答案为:≥0.04.
点评 本题考查离子检验、物质的量的有关计算,为高频考点,侧重考查学生判断及计算能力,明确离子性质、溶液中离子成分及其含量的计算方法是解本题关键,注意钾离子的判断,为难点.

①酸式滴定管用蒸馏水洗后,未用标准液润洗 ②碱式滴定管用蒸馏水洗后,未用待测液润洗 ③配制碱液的称量操作时固体吸潮 ④滴定前酸式滴定管尖嘴部分未充满溶液 ⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外 ⑥滴定前读数正确,达到滴定终点后,俯视读数.
| A. | ①③④ | B. | ②⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤ |
| A. | 水分子中共价键比氯化钠中离子键弱 | |
| B. | 水的相对分子质量比氯化钠的小 | |
| C. | 水分子间有范德华力,氯化钠分子间的作用力较强 | |
| D. | 水分子间是以范德华力相结合,相互作用较弱;氯化钠晶体中,Na+和Cl-以离子键相结合,作用力较强 |
| A. | Na+、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、K+ | B. | Na+、Cu2+、Br-、Ba2+ | ||
| C. | K+、MnO${\;}_{4}^{-}$、NO${\;}_{3}^{-}$、Na+ | D. | K+、Ca2+、SO${\;}_{3}^{2-}$、Cl- |
| A. | 合成氨工业中,氢气的转化率 | B. | 醋酸钠的水解程度 | ||
| C. | 水的离子积 | D. | 氢气的溶解度 |
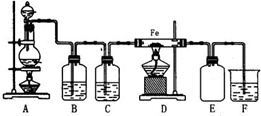 实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:
实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题: