题目内容
硫酸工业中2SO2(g)+O2(g)
2SO2(g);△H<0(放热反应)有关实验数据如下:
(1)在生产中常用过量的空气是为了 .
(2)高温对该反应的影响叙述正确的是(填选项序号,下同) .
(A)正反应为放热反应,高温使其反应速率减慢
(B)缩短达到平衡所需的时间
(C)降低SO2的转化率 (D)提高SO2的转化率
(3)实际生产中采用400-500℃的温度除了考虑速率因素外,还考虑到
(A)该温度下对环境和造成的污染最小
(B)此温度下SO2的转化率最高
(C)催化剂在该温度下活性最强,催化效果最佳
(4)增大压强,反应速率 (填“增大”、“减小”、“不变”),工业上常采用 (填“高压”、“常压”、“低压”).
(5)工业上常用 吸收SO2(填“浓硫酸”、“水”、“稀硫酸”)
| 催化剂 |
| △ |
| 压强 SO2的转化率 温度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
| 550℃ | 85.6% | 92.9% | 94.9% | 97.7% | 98.3% |
(2)高温对该反应的影响叙述正确的是(填选项序号,下同)
(A)正反应为放热反应,高温使其反应速率减慢
(B)缩短达到平衡所需的时间
(C)降低SO2的转化率 (D)提高SO2的转化率
(3)实际生产中采用400-500℃的温度除了考虑速率因素外,还考虑到
(A)该温度下对环境和造成的污染最小
(B)此温度下SO2的转化率最高
(C)催化剂在该温度下活性最强,催化效果最佳
(4)增大压强,反应速率
(5)工业上常用
考点:化学平衡的影响因素,化学反应速率的影响因素
专题:
分析:硫酸工业中2SO2(g)+O2(g)
2SO2(g);该反应为放热反应,升高温度平衡向逆反应分析移动,由于反应物气体体积大于生成物气体体积,则增大压强有利于平衡向正反应方向移动,题中实验数据表明反应在常压下反应的转化率较大,结合反应的实际和对设备的影响以及SO2和SO3的性质解答该题.
| 催化剂 |
| △ |
解答:
解:(1)在生产中常用过量的空气,增大反应物浓度,有利于平衡向正反应分析移动,提高SO2的转化率,
故答案为:使平衡正向移动,提高SO2的转化率;
(2)该反应为放热反应,升高温度平衡向逆反应分析移动,对SO2的转化不利,但升高温度可增大反应速率,主要考虑催化剂的活性,如温度过低,反应速率过慢,不利于工业生产,
故选:BC;
(3)升高温度平衡向逆反应分析移动,对SO2的转化不利,但升高温度可增大反应速率,主要考虑催化剂的活性,故选:C;
(4)增大压强,反应速率增大,由于反应物气体体积大于生成物气体体积,则增大压强有利于平衡向正反应方向移动,但题中实验数据表明反应在常压下反应的转化率较大,无采用高压的必要,况且,采用高压还受动力、设备等条件的限制,提高了成本,
故答案为:增大;常压;
(4)水和三氧化硫反应生成硫酸,反应放热,易形成酸雾而导致吸收效果差,但用浓H2SO4吸收则不易形成酸雾,吸收效果好,故答案为:浓硫酸.
故答案为:使平衡正向移动,提高SO2的转化率;
(2)该反应为放热反应,升高温度平衡向逆反应分析移动,对SO2的转化不利,但升高温度可增大反应速率,主要考虑催化剂的活性,如温度过低,反应速率过慢,不利于工业生产,
故选:BC;
(3)升高温度平衡向逆反应分析移动,对SO2的转化不利,但升高温度可增大反应速率,主要考虑催化剂的活性,故选:C;
(4)增大压强,反应速率增大,由于反应物气体体积大于生成物气体体积,则增大压强有利于平衡向正反应方向移动,但题中实验数据表明反应在常压下反应的转化率较大,无采用高压的必要,况且,采用高压还受动力、设备等条件的限制,提高了成本,
故答案为:增大;常压;
(4)水和三氧化硫反应生成硫酸,反应放热,易形成酸雾而导致吸收效果差,但用浓H2SO4吸收则不易形成酸雾,吸收效果好,故答案为:浓硫酸.
点评:本题以硫酸的工业制备为载体,综合考查化学平衡移动和影响平衡移动的因素,为高考常见题型,侧重于学生分析能力和数据处理能力的考查,注重于化学对生活、生产的指导,难度中等.

练习册系列答案
相关题目
将一小粒金属投入盛有水的小烧杯中,实验现象描述不合理的是( )
| A、金属钠块浮于液面上,四处游动 |
| B、金属钠熔化成液态小球 |
| C、烧杯内溶液颜色逐渐变红 |
| D、听到(可燃性气体)轻微的爆鸣声 |
下列叙述不正确的是( )
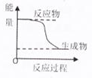

| A、化学平衡发生移动,平衡常数不一定发生变化 |
| B、升高温度会增大化学反应速率,其原因是增加了活化分子的百分数 |
| C、某化学反应的能量变化如图所示,则反应的△H>0 |
| D、电解熔融Al2O3是将部分电能转化为化学能 |
2SO2+O2?2SO3是接触法制硫酸工艺中的一个重要反应,下列关于该反应的说法中错误的是( )
| A、增加SO2的浓度能加快该反应的速率 |
| B、反应过程中SO2能全部转化为SO3 |
| C、降低体系温度会减慢该反应的速率 |
| D、使用催化剂能改变该反应的速率 |
设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
A、标准状况下,1L辛烷完全燃烧所生成的气体产物的分子数为
| ||
| B、1mol羟基(-OH)所含的电子总数为10NA | ||
| C、27g1,3-丁二烯分子中含有C=C双键数为NA | ||
| D、1mol碳正离子(CH3+)所含的电子总数为9NA |
在某一化学反应,0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为( )
| A、3mol/L |
| B、0.3mol/L?s |
| C、0.6mol/L?s |
| D、0.1mol/L?s |
下列说法不正确的是( )
| A、焓变是与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| B、一个反应能否自发进行取决于该反应放热还是吸热 |
| C、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| D、一个反应能否自发进行,与焓变和熵变的共同影响有关 |
容积不变的密闭容器中,对于可逆反应A(g)+B(s)?2C(g),不能判断达到化学平衡状态的是( )
| A、体系压强不变 |
| B、单位时间消耗nmolA,同时生成2nmolC |
| C、A的转化率不变 |
| D、容器内气体密度不变 |