题目内容
16.工业上以CaO和HNO3为原料制备Ca(NO3)2•4H2O晶体.为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为70%.分析 工业上以CaO和HNO3为原料制备Ca(NO3)2•4H2O晶体.为确保制备过程中既不补充水分,也无多余的水分,也就是硝酸溶液中的水全部参与化学反应生成Ca(NO3)2•4H2O晶体,结合方程式CaO+2HNO3+3H2O=Ca(NO3)2•4H2O计算.
解答 解:根据化学方程式:CaO+2HNO3+3H2O=Ca(NO3)2•4H2O
126 54
根据题意,硝酸溶液中的水和硝酸要全部参与化学反应,即当有126g硝酸参与反应时,硝酸溶液中的水应是54g,因此硝酸溶液中溶质的质量分数是$\frac{126g}{126g+54g}$×100%=70%;
故答案为:70%.
点评 本题考查了溶液中溶质的质量分数计算,题目难度不大,主要考查了根据化学方程式计算溶液中溶质的质量分数,培养学生的理解能力和计算能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
4.在反应3BrF3+5H2O=HbrO3+Br2+9HF+O2中,如果有5个水分子发生反应,反应物分子中化合价升高的分子总数和化合价降低的分子总数之比为( )
| A. | 3:1 | B. | 3:2 | C. | 3:5 | D. | 5:3 |
1.将一小块金属钠投入到足量下列物质中,既能生成气体,又能生成白色沉淀的是( )
| A. | MgSO4溶液 | B. | BaCl2溶液 | C. | Fe2(SO4)3溶液 | D. | CuCl2溶液 |
8.下列叙述正确的是( )
| A. | 随着化学科学的发展和提高,自然界的一切都将以人的意志为转移 | |
| B. | 生物固氮是指植物通过叶面直接吸收空气的氮气 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 绿色食品是不含任何化学物质的食品 |
5.能正确表示下列反应的离子方程式的是( )
| A. | 将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 碳酸钠水解:CO32-+H2O═HCO3-+OH- | |
| C. | 食醋滴到鸡蛋壳上:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 将铜粉加入稀硫酸中:Cu+2H+═Cu2++H2↑ |
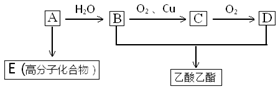 已知:
已知: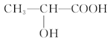 乳酸兼有乙酸和乙醇所具有的化学性质现以A为原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示:
乳酸兼有乙酸和乙醇所具有的化学性质现以A为原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示: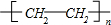 .
. .
.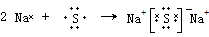 .
.