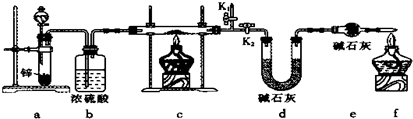
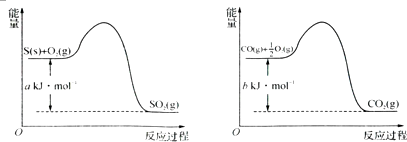
题目内容
| |||||||||||||||||||||||||||||||
答案:2.DE;
解析:
解析:
(1) |
2.0 烧杯 |
(3) |
托盘天平、药匙、500 mL容量瓶 |
(4) |
答案:用胶头滴管逐滴加水,同时平视观察,当凹液面与刻度线相切时,立即停止加水. 解析:一定物质的量浓度溶液的配制,从大的方面来说,包括所需溶质的量计算和溶液体积的确定两大部分.整个过程可细分为六个步骤:计算、称量、溶解、转移、定容、贮存. 一定物质的量浓度溶液的配制还要使用多种仪器,它们通常是容量瓶、托盘天平(所需溶质为固体时使用)、量筒、烧杯、玻璃棒、胶头滴管、药匙(所需溶质为固体时使用)、试剂瓶. |

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目