题目内容
11.要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作,最佳的顺序为( )①加入适量氯水②加入适量稀H2SO4 ③加入少量KSCN溶液.
| A. | ①③ | B. | ③② | C. | ③① | D. | ①②③ |
分析 先根据Fe3+的特征反应判断溶液不含Fe3+;然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在.
解答 解:因为NH4SCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先滴加NH4SCN溶液,不显红色,说明原溶液不含有Fe3+,
再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,即进行如下实验的最佳顺序为③①,
故选C.
点评 本题考查离子的检验,注意滴加氧化剂、KSCN溶液的顺序不能颠倒,如果颠倒,无法确定溶原液将中是否含有Fe3+,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
1.下列物质既能与氢氧化钠溶液又能与盐酸反应的是( )
| A. | NH4Cl | B. | Mg(OH)2 | C. | Al2O3 | D. | Fe2O3 |
19.下列实验装置或操作正确的是( )
| A. |  除去附着在铁屑表面的铝 | B. |  实验室制取乙酸乙酯 | ||
| C. |  实验室制乙烯 | D. |  分离酒精和水 |
6.下列说法一定正确的是( )
| A. | 酸性物质与酸性物质、碱性物质与碱性物质不能反应 | |
| B. | 溶液中某离子浓度减小发生了化学反应 | |
| C. | 含同一元素的不同化合物,该元素的化合价越高,其氧化性越强 | |
| D. | 多个电解池串联,通过每个电极电子的物质的量相等 |
16.常温下,下列溶液中与1×10-5mol/L的NaOH溶液pH相同的是( )
| A. | 把pH=6的盐酸稀释1000倍 | |
| B. | 把pH=8的NaOH溶液稀释10倍 | |
| C. | 把10mL 1×10-5mol/L的H2SO4溶液与10mL 4×10-5mol/L的NaOH溶液相混合 | |
| D. | 把c(OH-)=10-5mol/L的NaOH溶液10mL加到100mL浓度为10-4mol/L的NaOH溶液中 |
3.下列说法正确的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 吸热反应在一定条件下也能发生 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-235.8 kJ/mol 则氢气的燃烧热为235.8KJ/mol |
1.分别中和10mL1.0mol/L的HCl溶液,消耗了等体积的氢氧化钠溶液和氨水溶液,则氢氧化钠溶液和氨水溶液的关系是( )
| A. | 所含溶质质量相等 | B. | 所含溶质物质的量氨水多 | ||
| C. | 溶液物质的量浓度相等 | D. | 电离度相等 |
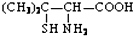 ,请写出青霉氨基酸可能具有的一种化学性质能与碱发生中和反应.
,请写出青霉氨基酸可能具有的一种化学性质能与碱发生中和反应.