题目内容
【题目】已知在一个5L的密闭容器中发生反应![]() ,该反应的平衡常数和温度的关系如下:
,该反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
①该反应的平衡常数表达式K=__________,
②该反应的![]() _________0 (填“>”“<”或“=”)。
_________0 (填“>”“<”或“=”)。
③ 判断该反应是否达到平衡的依据为(_______)
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
E. 气体的平均相对分子质量不随时间改变
④1200℃时反应![]() 的平衡常数的值为______________。
的平衡常数的值为______________。
⑤830℃时,充入2.0mol的A和8.0mol的B,如反应初始6s内A的平均反应速率v(A)=0.03mol/(L· s)则6s时c(A)=___________![]() ,C的物质的量为__________mol;若反应经一段时间后,达到平衡时A的转化率为____________,如果这时向该密闭容器中再充入1mol氩气(氩气不参与该反应),平衡时A的转化率将____________(填“增大”“减小” 或“不变”), 如果这时向该密闭容器中再充入1.0mol的A和4.0mol的B, 平衡时A的转化率将____________(填“增大”“减小” 或“不变”)。
,C的物质的量为__________mol;若反应经一段时间后,达到平衡时A的转化率为____________,如果这时向该密闭容器中再充入1mol氩气(氩气不参与该反应),平衡时A的转化率将____________(填“增大”“减小” 或“不变”), 如果这时向该密闭容器中再充入1.0mol的A和4.0mol的B, 平衡时A的转化率将____________(填“增大”“减小” 或“不变”)。
【答案】![]() < C 2.5 0.22 0.9 80% 不变 不变
< C 2.5 0.22 0.9 80% 不变 不变
【解析】
①根据该反应的方程式,写出平衡常数表达式K;
②根据图表信息可知,温度升高,平衡左移,平衡常数减小,正反应放热;
③根据正逆反应速率相等,各组分的浓度保持不变以及由此衍生的其它物理量进行分析;
④根据图表信息,结合反应方程式进行计算;
⑤根据速率计算公式、转化率计算公式进行分析;体积不变,充入和反应无关的气体,平衡不移动;同比例减小反应物,等效于减压过程,据以上分析进行解答。
①该反应的平衡常数表达式![]() ;
;
②随着温度的升高,该反应的平衡常数逐渐减小,说明反应放热,该反应的![]() <0;
<0;
③A. 该反应前后气体的物质的量不变,故反应中压强为定值,压强不变无法判断反应达到平衡,A错误;
B. 该反应前后气体的总质量不变,气体体积也不变,故气体的密度为定值,密度不变无法判断反应达到平衡,B错误;
C. c(A)不随时间改变可以判断反应达到平衡,C正确;
D. 单位时间里生成C和D的物质的量一定相等,故无法用来判断反应是否平衡,D错误;
E. 反应前后气体的总质量和总物质的量均不会发生改变,故气体的平均摩尔质量也不变,无法用来判断反应是否平衡,E错误;
故答案选C;
④1200℃时反应![]() 的平衡常数的值为
的平衡常数的值为![]() ;
;
⑤6s时△c(A)=v(A)×t=0.03×6=0.18mol/L,则剩余的A的浓度为c(A)=2mol÷5L-0.18=0.22mol/L,生成的C的浓度为0.18mol/L,则C的物质的量为0.18×5=0.9mol;
假设达到平衡时A转化了amol,则BCD三种物质均转化了amol,则A剩余(2-a)mol,B剩余(8-a)mol,CD均剩余amol,则反应的平衡常数为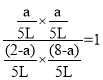 ,计算得a=
,计算得a=![]() ,则A的转化率为
,则A的转化率为![]() ÷2mol×100%=80%;由于是恒容反应,充入氩气,对平衡无影响,A的转化率不变,如果这时向该密闭容器中再充入1.0mol的A和4.0mol的B,与原平衡等效,A的转化率不变。
÷2mol×100%=80%;由于是恒容反应,充入氩气,对平衡无影响,A的转化率不变,如果这时向该密闭容器中再充入1.0mol的A和4.0mol的B,与原平衡等效,A的转化率不变。