题目内容
将羧酸的碱金属盐电解可生成烃类化合物,例如:2CH3COOK+2H2O
CH3-CH3↑+2CO2↑+H2↑+2KOH
现充分电解CH2Cl-COOK水溶液,并加热电解后的水溶液,则下列说法中合理的是( )
| ||
现充分电解CH2Cl-COOK水溶液,并加热电解后的水溶液,则下列说法中合理的是( )
| A、电解时阳极产生氢气 |
| B、加热后有不溶于水的油状物生成 |
| C、混合液蒸干后得到的固体物质是KOH |
| D、混合液蒸干后得到的固体物质是KCl |
考点:电解原理
专题:
分析:依据电解原理,阴离子移向阳极失去电子发生氧化反应,阳离子移向阴极得电子发生还原反应,总反应为2CH2Cl-COOK+2H2O
Cl-CH2-CH2-Cl+2CO2↑+H2↑+2KOH,加热条件下KOH与1,2-二氯乙烷发生反应Cl-CH2-CH2-Cl+2KOH
HO-CH2-CH2-OH+2KCl,据此分析.
| 电解 |
| △ |
解答:
解:电解时,阳极上失电子化合价升高发生氧化反应,阴极上得电子化合价降低发生还原反应,羧酸阴离子在阳极失去电子,然后脱羧基得到烃基自由基,两个烃基自由基可以生成卤代烃1,2-二氯乙烷,同时阳极上还有二氧化碳生成;阴极是氢离子得到电子变成氢气,同时生成了KOH,在与1,2-二氯乙烷在加热条件下发生反应Cl-CH2-CH2-Cl+2KOH
HO-CH2-CH2-OH+2KCl.
A、二氧化碳是在阳极羧酸根离子放电后的脱羧反应生成,故A错误;
B、加热后,1,2-二氯乙烷和氢氧化钾反应生成乙二醇等有机物,易溶于水,故B错误;
C、电解后生成的二氧化碳挥发,将电解后混合液蒸干后,1,2-二氯乙烷和氢氧化钾反应生成乙二醇等有机物挥发,得到的固体主要是KCl,故C错误;
D、电解后生成的二氧化碳挥发,将电解后混合液蒸干后,1,2-二氯乙烷和氢氧化钾反应生成乙二醇等有机物挥发,得到的固体主要是KCl,故D正确;
故选D.
| △ |
A、二氧化碳是在阳极羧酸根离子放电后的脱羧反应生成,故A错误;
B、加热后,1,2-二氯乙烷和氢氧化钾反应生成乙二醇等有机物,易溶于水,故B错误;
C、电解后生成的二氧化碳挥发,将电解后混合液蒸干后,1,2-二氯乙烷和氢氧化钾反应生成乙二醇等有机物挥发,得到的固体主要是KCl,故C错误;
D、电解后生成的二氧化碳挥发,将电解后混合液蒸干后,1,2-二氯乙烷和氢氧化钾反应生成乙二醇等有机物挥发,得到的固体主要是KCl,故D正确;
故选D.
点评:本题考查了电解原理,难度较大,可根据阴阳极上得失电子判断产物,根据题干所给信息分析应用.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
有1体积的乙烯和乙炔的混合气体,恰好能跟相同条件下的1.6体积的H2完全反应生成乙烷,则混合气体中,乙烯和乙炔的物质的量之比是( )
| A、1:4 | B、3:7 |
| C、2:3 | D、2:1 |
邻羟基苯甲酸,俗名水杨酸,结构简式为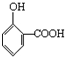 ,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )
,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )
 ,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )
,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )| A、NaCl |
| B、Na2SO4 |
| C、NaOH |
| D、NaHCO3 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、由水电离产生的c(H+)=10-13mol/L的无色溶液中:ClO-、Na+、HCO3-、Mg2+ |
| B、使pH试纸变为深蓝色的溶液中:K+、CO32-、Na+、AlO2- |
| C、加入Mg能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- |
| D、使甲基橙变红的溶液中:MnO4-、NO3-、Na+、Fe2+ |
若溶液中由水电离产生的c(OH-)=1×10-14mol?L-1,满足条件的溶液中一定可以大量共存的离子组是( )
| A、Al3+,Na+,NO3-,Cl- |
| B、K+,Na+,Cl-,NO3- |
| C、K+,Na+,Cl-,CH3COO- |
| D、K+,NH4+,SO42-,NO3- |
室温下,pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A、使温度都升高20℃后,两溶液的pH均不变 |
| B、加相同量的水稀释,两溶液的pH变化程度相同 |
| C、加足量的锌时,刚开始反应醋酸产生的氢气比盐酸快 |
| D、加足量的锌充分反应后,醋酸产生的氢气比盐酸多 |




