题目内容
1.关于如图有机物说法正确的是( )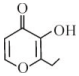
| A. | 该有机物的分子式为C7H7O3 | |
| B. | 1 mol该有机物只能与2 mol H2发生加成反应 | |
| C. | 该有机物在一定条件下能发生取代、氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
分析 有机物含有碳碳双键、羰基、羟基以及醚键,结合烯烃、酮、醇的性质解答该题.
解答 解:A.由结构简式可知有机物的分子式为C7H8O3,故A错误;
B.能与氢气反应的为碳碳双键、羰基,则1 mol该有机物只能与3 mol H2发生加成反应,故B错误;
C.含有羟基,可发生取代反应和氧化反应,且碳碳双键也可发生氧化反应,故C正确;
D.不饱和度为4,而芳香族同分异构体能发生银镜反应,应含有苯环和醛基,不饱和度为5,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重不饱和烃、醇的性质的考查,选项D为易错点,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
11.某温度下,在一个2L的密闭容器中加入4mol A和 2mol B进行如下反应:3A(g)+2B(g)?4C(s)+D(g),反应2min 后达到平衡,测得生成1.6mol C,下列说法正确的是( )
| A. | 前2 min,D的平均反应速率为0.2 mol•L-1•min-1 | |
| B. | 此时,B的平衡转化率是40% | |
| C. | 增大该体系的压强,平衡不移动,化学平衡常数不变 | |
| D. | 增加B,平衡向右移动,B的平衡转化率增大 |
12.a、b、c、d为短周期元素,a的原子中只有1个电子,b与a可形成多种有机化合物,c的单质是构成空气的主要成分,d元素的焰色反应呈黄色.下列叙述错误的是( )
| A. | 简单离子半径:c>d | |
| B. | a、b、c、d中,d的原子半径最大 | |
| C. | a与b、c形成的化合物可能含有非极性键 | |
| D. | a与其它元素形成的化合物均为共价化合物 |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100g 98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 常温下,2.7gAI与足量浓度为18mo1/L的浓硫酸反应时,转移的电子数为0.3NA | |
| C. | 标准状况下,22.4L的CCI4含有的CCl4分子数大于NA | |
| D. | 1 mol笨完全转化为环己烷,参与反应的碳碳双键数为3NA |
16.下列实验操作、现象和解释或结论均正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将铝片分別加入浓HNO3和NaOH浓溶液中 | NaOH浓溶液中的铝片溶解 | 铝不与浓HNO3反应 |
| B | 向紫色石蕊试液中通入足量二氧化硫 | 溶液由紫色变为红色 | 二氧化硫与水反应有酸性物质生成 |
| C | 将分别蘸有浓氨水和浓硝酸的两根玻璃棒相互靠近 | 有白烟生成 | 浓硝酸具有强氧化性 |
| D | 向待测液中加入盐酸酸化的硝酸钡溶液 | 有白色沉淀生成 | 待测液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
6.《本草图经》中关于绿矾的分解有如下描述:“绿矾形似朴消(Na2SO4•10H2O)而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁者是真也.”对此段话的说明中肯定错误的是( )
| A. | 绿矾的化学式为FeSO4•7H2O | |
| B. | 绿矾分解过程中没有发生电子的转移 | |
| C. | “色赤”物质可能是Fe2O3 | |
| D. | 流出的液体中可能含有硫酸 |
13.自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛( 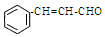 ),杏仁含苯甲醛(
),杏仁含苯甲醛( 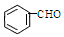 ),下列说法错误的是( )
),下列说法错误的是( )
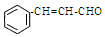 ),杏仁含苯甲醛(
),杏仁含苯甲醛(  ),下列说法错误的是( )
),下列说法错误的是( )| A. | 肉桂醛和苯甲醛互为同系物 | |
| B. | 肉桂醛能发生加成反应、取代反应和加聚反应 | |
| C. | 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团 | |
| D. | 苯甲醛分子中所有原子可能位于同一平面内 |
10.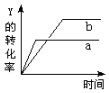 反应 2X(g)+3Y(g)?Z(g)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间的关系如图所示.若使曲线a变为曲线b,可采取( )
反应 2X(g)+3Y(g)?Z(g)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间的关系如图所示.若使曲线a变为曲线b,可采取( )
 反应 2X(g)+3Y(g)?Z(g)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间的关系如图所示.若使曲线a变为曲线b,可采取( )
反应 2X(g)+3Y(g)?Z(g)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间的关系如图所示.若使曲线a变为曲线b,可采取( )| A. | 降低温度 | B. | 减小压强 | C. | 加入催化剂 | D. | 增大Y的浓度 |
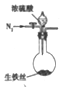
11.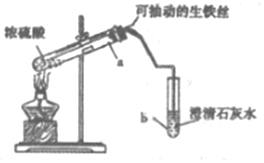 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
(1)该实验的操作依次是CAB (填序号).
A.加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯
B.将生铁丝上提离开液面
C.连接好装置,检验气密性,加人试剂
(2)b中的澄清石灰水变浑浊,甲同学认为产生的肯定是SO2气体,你是否同意不同意(填“同意”或“不同意)理由是.
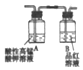
(3)乙同学认为该反应过程中产生SO2、CO2、H2三种气体,请用如图所列各装置设计一个实验,来验证所产生的气体.(图中加热装置、夹持仪器省略,除装置⑤外,其他装置试剂均为足量)
①装置的连接顺序(按产物气流从左至右的方向→E→A→C→D→B(填装置的编号)
②证明生成的气体中存在SO2的现象是装置①中溶液紫红色变浅说明生成SO2,相应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量之比为1:4
(5)已知常温下H2SO3的电离平衡常数为:Ka1=10×10-1.9 Ka2=10-7.2计算0.1mol•L-1NaSO3溶液的pH
值10.1(忽略SO32-的二级水解)
 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.(1)该实验的操作依次是CAB (填序号).
A.加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯
B.将生铁丝上提离开液面
C.连接好装置,检验气密性,加人试剂
(2)b中的澄清石灰水变浑浊,甲同学认为产生的肯定是SO2气体,你是否同意不同意(填“同意”或“不同意)理由是.
(3)乙同学认为该反应过程中产生SO2、CO2、H2三种气体,请用如图所列各装置设计一个实验,来验证所产生的气体.(图中加热装置、夹持仪器省略,除装置⑤外,其他装置试剂均为足量)
| A | B | C | D | E |
 |  |  |  |  |
②证明生成的气体中存在SO2的现象是装置①中溶液紫红色变浅说明生成SO2,相应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量之比为1:4
(5)已知常温下H2SO3的电离平衡常数为:Ka1=10×10-1.9 Ka2=10-7.2计算0.1mol•L-1NaSO3溶液的pH
值10.1(忽略SO32-的二级水解)