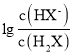题目内容
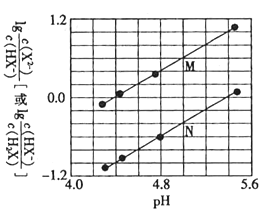
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数![]() 随溶液pH的变化曲线如下图所示。下列说法正确的是( )
随溶液pH的变化曲线如下图所示。下列说法正确的是( )
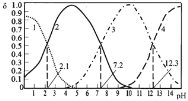
A.曲线1和曲线2分别表示![]() (H3PO4)和
(H3PO4)和![]() (HPO42-)的变化
(HPO42-)的变化
B.25℃时,H3PO4的电离常数K1=10-2.1
C.pH=7.2时,溶液中c(H2PO4-)+c(HPO42-)+c(OH-)=c(Na+)+c(H+)
D.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3 mol/L
【答案】B
【解析】
A.起始时段附近浓度较高的为H3PO4,随着pH缓慢增大,溶液中H3PO4浓度降低,H2PO4-浓度增大,然后H2PO4-浓度降低,HPO42-浓度增大,然后HPO42-浓度降低,PO43-浓度增大,所以曲线1表示δ(H3PO4),曲线2表示δ(H2PO4-),曲线3表示δ(HPO42-),曲线4表示δ(PO43-),A错误;
B.根据图象,溶液中c(H3PO4)=c(H2PO4-)时,即δ(H3PO4)=δ(H2PO4-),溶液的pH=2.1,则H3PO4的电离常数K1=c(H+)=10-2.1,B正确;
C.pH=7.2时,溶液中溶液中δ(H2PO4-)=δ(HPO42-),则c(H2PO4-)=c(HPO42-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH-),C错误;
D.pH=12.3时,溶液中δ(HPO42-)=δ(PO43-),则c(HPO42-)=c(PO43-),溶液中c(H+)=10-12.3mol/L,H+由HPO42-及H2O共同电离产生而来,D错误;
故合理选项是B。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
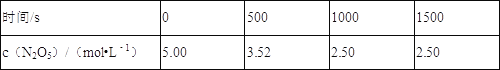
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1