题目内容
9.在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应.生成NO的物质的量( )| A. | 0.01mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
分析 根据n=cV分别计算出硝酸、硫酸的物质的量,然后计算出硝酸根离子、氢离子的物质的量,再根据反应3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O判断过量,最后根据不足量计算出生成一氧化氮的物质的量.
解答 解:在某100mL混酸中,硝酸的物质的量n(HNO3)=0.1L×0.4mol/L=0.04mol,硫酸的物质的量为:n(H2SO4)=0.1L×2×0.2moL/L=0.04moL,
所以氢离子的物质的量:n(H+)=0.04moL+2×0.04moL=0.08mol,
铜粉的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,
依据方程式:
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
3 2 8 2
0.1mol $\frac{0.2}{3}$mol $\frac{0.8}{3}$mol
$\frac{0.2}{3}$mol≈0.067mol>0.04mol,
$\frac{0.8}{3}$mol≈0.267mol>0.08mol,
硝酸根离子和氢离子都不足,其中消耗0.04mol硝酸根离子需要反应氢离子的物质的量为:0.04mol×4=0.16mol,显然氢离子不足,需要根据H+计算生成NO的物质的量,
所以完全反应生成一氧化氮的物质的量为:n(NO)=$\frac{2}{8}$×0.08mol=0.02mol,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,根据反应物的量正确判断过量情况为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
19.下列过程中化学键未被破坏的是( )
| A. | 碘升华 | B. | 溴与H2生成HBr | C. | SO2气体溶于水 | D. | NaCl固体溶于水 |
17. 实验室中一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2S、Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )
实验室中一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2S、Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )
 实验室中一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2S、Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )
实验室中一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2S、Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )| A. | 只用盐酸一种试剂就可以确定该固体M的成分 | |
| B. | 往溶液中加入稀硝酸酸化的BaCl2溶液,若有白色沉淀生成,则固体M为Na2SO4 | |
| C. | 往溶液中通入二氧化碳,若有白色沉淀生成,则固体M为Na2SiO3 | |
| D. | 只用氯水一种试剂就可以确定该固体M的成分 |
4.已知KMnO4、浓盐酸在常温下反应能生成Cl2.若用如图所示的实验装置来制备纯净、干燥的氯气,并实验它与金属的反应.每个虚线框表示一个单元装置,其中有错误的是( )
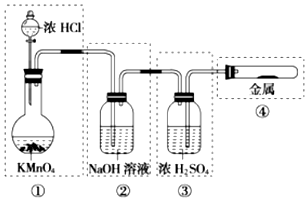

| A. | ①和②处 | B. | ②处 | C. | ②和③处 | D. | ②③④处 |
14.天然气干法脱硫涉及反应为:H2(g)+CO(g)+SO2(g)?H2O(g)+CO2(g)+S(s)+Q(Q>0).无法提高单位时间脱硫率的措施是( )
| A. | 增加CO的浓度 | B. | 加压 | C. | 分离出硫 | D. | 加催化剂 |
18.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.下列说法不正确的是( )
| A. | 当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 | |
| B. | 淀粉水解的最终产物可与新制的Cu(OH)2反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 | |
| D. | 棉、麻、丝、毛完全燃烧只生成CO2和H2O |
 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空: .
. 为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.
为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.