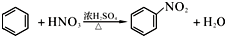题目内容
20.现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数是原子核外电子层数的2倍 |
| Y | 最高价氧化物既能与强酸反应,又能与强碱反应 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最高价氧化物的水化物为无机酸中最强的酸 |
 ;
;(2)Y的最高价氧化物与强碱反应的离子方程式Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(3)元素X与元素T的非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是c(填字母);
a.X的氢化物比T的氢化物稳定
b.常温下X的单质和T的单质状态不同
c.T的单质能把X从其氢化物中置换出来
d..最高价氧化物的水化物的酸性X>T.
分析 短周期元素,X元素原子M层上的电子数是原子核外电子层数的2倍,X原子有3个电子层,M层上有6个电子,则X为S元素;Y的最高价氧化物既能与强酸反应,又能与强碱反应,则Y为Al元素;常温下Z的单质为双原子分子,其氢化物水溶液呈碱性,该氢化物为氨气,则Z为N元素;T的最高价氧化物的水化物为无机酸中最强的酸,该酸为高氯酸,则T为Cl元素,据此结合元素周期律知识解答.
解答 解:短周期元素,X元素原子M层上的电子数是原子核外电子层数的2倍,X原子有3个电子层,M层上有6个电子,则X为S元素;Y的最高价氧化物既能与强酸反应,又能与强碱反应,则Y为Al元素;常温下Z的单质为双原子分子,其氢化物水溶液呈碱性,该氢化物为氨气,则Z为N元素;T的最高价氧化物的水化物为无机酸中最强的酸,该酸为高氯酸,则T为Cl元素,
(1)元素Z为N,其单质为氮气,氮气分子中含有氮氮三键,其电子式为 ,
,
故答案为: ;
;
(2)Y的最高价氧化物为氧化铝,氧化铝与强碱反应的离子方程式为:Al2O3+2OH-+3H2O=2[Al(OH)4]-,
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(3)元素X为S,元素T为Cl,二者位于同一周期,原子序数Cl>S,则非金属性:Cl>S;
a.非金属性:Cl>S,则X的氢化物比T的氢化物弱,故a错误;
b.常温下X的单质和T的单质状态不同,不能根据物质判断非金属性,故b错误;
c.T的单质能把X从其氢化物中置换出来,说明非金属性:Cl>S,故c正确;
d..最高价氧化物的水化物的酸性X<T,故d错误;
故答案为:Cl;c.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,根据题干信息正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析、理解能力及逻辑推理能力.

 +H2O(未配平),下列有关说法正确的是( )
+H2O(未配平),下列有关说法正确的是( )| A. | 该反应属于中和反应 | B. | 三聚氰胺的分子式为C3H6N3O3 | ||
| C. | 三聚氰胺分子中只有极性键 | D. | 三聚氰胺属于离子化合物 |
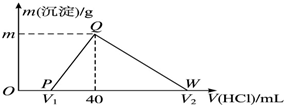 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )| A. | OP段发生的反应为:OH-+H+═H2O | B. | 图中V2为100 | ||
| C. | 沉淀的质量m为1.56 g | D. | 原合金质量为0.92 g |
| A. | 加成→消去 | B. | 加成→水解 | C. | 消去→加成 | D. | 消去→取代 |
 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )| 实验目的 | 试剂(或条件) | |
| A | 用稀硫酸比较铝和铁的金属活动性 | ①铝粉 ②铁钉 |
| B | 温度对H2O2分解反应速率的影响 | ①热水浴②冰水浴 |
| C | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇 ②煤油 |
| D | 用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去 | ①海水 ②蒸馏所得液体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | H2和D2互为同分异构体,其化学性质完全相同 | |
| B. | 电解一定量的D${\;}_{2}^{18}$O时,阴、阳两极所得气体的质量之比约为2:9 | |
| C. | 18O2和18O3互为同素异形体,其密度之比为2:3 | |
| D. | H${\;}_{2}^{16}$O、H${\;}_{2}^{17}$O、H${\;}_{2}^{18}$O互为同位素,都能与金属钠发生反应 |
 ;
; 其单体的键线式
其单体的键线式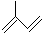 ;
; 的名称(系统命名法)3,3,4-三甲基已烷.
的名称(系统命名法)3,3,4-三甲基已烷.