题目内容
5.把含硫酸铵和硝酸铵的混合液2a L分成两等份.一份加入bmol NaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为( )| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-4c}{a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{b-4c}{a}$ |
分析 (NH4)2SO4和NH4NO3的混合溶液中加入bmol烧碱加热,恰好使全部NH4+转化为氨气逸出,消耗的氢氧化钠中钠离子的物质的量就等于铵离子的物质的量;氯化钡与硫酸反应,钡离子的物质的量就等于硫酸根离子的物质的量,据此可以计算出硫酸铵的物质的量,再根据总的铵离子的物质的量计算出硝酸铵的物质的量,最后根据c=$\frac{n}{V}$计算出溶液中硝酸根离子的物质的量浓度.
解答 解:把含硫酸铵和硝酸铵的混合液2a L分成两等份,每份的体积为aL,
一份加入bmol烧碱加热,恰好使全部NH4+转化为氨气逸出,反应生成了硫酸钠和硝酸钠,所以钠离子的物质的量就等于铵离子的物质的量,即:n(NH4+)=n(Na+)=bmol;
另一份与含cmol BaCl2的溶液恰好反应,说明硫酸根离子的物质的量为cmol,硫酸铵中的铵离子的物质的量为2c,则硝酸铵的物质的量为:b-2c,
所以硝酸铵的物质的量浓度为:c(NH4NO3)=c(NO3-)=$\frac{b-2c}{a}$mol/L,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确发生反应实质为解答根据,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.可逆反应aA(s)+bB(g)?cC(g)+dD(g),反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是( )
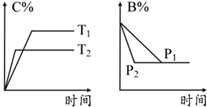

| A. | T1>T2 | B. | 正反应为放热反应 | ||
| C. | P1>P2 | D. | a+b=c+d |
13.下列分离提纯的方法正确的是( )
| A. | 用酒精提取碘水中的碘 | |
| B. | 重结晶法除去硝酸钾中的氯化钠 | |
| C. | 蒸馏法分离乙醇和苯酚 | |
| D. | 除去乙烷中少量的乙烯,方法是在光照条件下通氯气 |
10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是( )
| A. | R元素处于第三周期ⅥA族 | B. | R元素是较活泼的非金属元素 | ||
| C. | 原子核外共有14个电子 | D. | 元素最低化合价为-2价 |
17.下列化合物的同分异构体数目为7种的是(不考虑立体异构)( )
| A. | C6H10 | B. | C4H8 | C. | C4H10O | D. | C5H11Cl |
14.已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D、T,从水分子的组成来看,自然界的水一共有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 18种 |
1.下列实验事实与对应的方程式使用正确的是( )
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- | |
| B. | 硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I++O2+2H2O═2I2+4OH- | |
| C. | 钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O═4OH- | |
| D. | 氨气催化氧化生产硝酸的主要反应:4NH3+7O2$\frac{\underline{\;催化剂\;}}{高温}$4NO2+6H2O |
 .
. ,反应类型取代反应.
,反应类型取代反应. 表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.
表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.