��Ŀ����
9���ϳɰ��������ѧ������չʷ�ϵ�һ���ش�ͻ�ƣ��䷴Ӧԭ��Ϊ��N2��g��+3H2��g��?2NH3��g����H��0�ش��������⣺
��1��450��ʱ����2L�ܱ������г���1molN2����2.6molH2����Ӧ������NH3�����ʵ���Ũ����ʱ��ı仯��������ʾ��
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c��NH3��/��mol•L-1�� | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 �ٷ�Ӧ��ʼ��5min�ڣ�����NH3��ƽ����Ӧ����Ϊ0.016mol/��L��min����ƽ��ʱH2��ת����Ϊ23.1%���÷�Ӧ��ƽ�ⳣ��Ϊ0.1��
�ٷ�Ӧ��ʼ��5min�ڣ�����NH3��ƽ����Ӧ����Ϊ0.016mol/��L��min����ƽ��ʱH2��ת����Ϊ23.1%���÷�Ӧ��ƽ�ⳣ��Ϊ0.1�������������У���˵���úϳɰ���Ӧ�Ѵﵽƽ�����BD������ĸ���ţ���
A�������ڵ������ܶȱ��ֲ���
B�������ڵ�����ѹǿ���ֲ���
C��������N2��H2��NH3���ʵ���Ũ��֮��Ϊ1��3��2
D����λʱ��������a molN2��ͬʱ����3amolH2
��������ƽ����ϵ�г���l mol N2��2.5molH2��0.5mol NH3��ƽ�⽫�����ƶ���������ƶ������������ƶ������ƶ�������
��2����ͼ��ʾ��Ӧ�����뷴Ӧ���̵Ĺ�ϵ������Ӧ�ﵽƽ��ϸı����������ı�N2��H2��NH3������ÿ��ֻ�ı�һ��������������t1ʱ�̸ı�������������¶ȣ���ʾƽ��������NH3�ĺ�����ߵ�һ��ʱ����t0��t1��
��3��һ�ֺϳɰ����·���Ϊ���ڳ�ѹ�£����������ú���ϡ�͵ĵ����ֱ�ͨ��570��ĵ��أ���������ͨ���Ķ���մɹ���������ʣ������͵����ڵ缫�Ϻϳɰ�������ת���ʴﵽ78%���õ��������ĵ缫��ӦʽΪN2+6H++6e-�T2NH3��
��4��25��ʱ��pH=a�İ�ˮ��pH=b��������������ϣ�ǡ����ȫ��Ӧ������¶���ԭ��ˮ����İٷ����ɱ�ʾΪA��
A.10��a+b-12��% B.10��a+b-14��% C.10��12-a-b��% D.10��14-a-b��%
���� ��1���ٸ���v=$\frac{��c}{��t}$����NH3��ƽ����Ӧ���ʣ����ݰ���Ũ�ȼ�������Ũ�ȱ仯����ƽ��ʱ�����Ũ�ȣ�����ת����=$\frac{����Ũ�ȱ仯��}{������ʼŨ��}$��100%��ƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$��
�ڷ�Ӧ����ƽ��ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��������䣬�ɴ�����������һЩ���������䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ�⣻
�ۼ���Ũ����Qc����ƽ�ⳣ���Ƚ��жϷ�Ӧ���з���
��2���ϳɰ����������С�ķ��ȷ�Ӧ��t1ʱ�̸ı���������淴Ӧ��������ƽ����Ӧ�ƶ���Ӧ�������¶ȣ����µ���ƽ������������ͣ�t3ʱ�̸ı���������淴Ӧ��������ƽ�ⲻ�ƶ��������ĺ������䣬Ӧ�Ǽ��������t4ʱ�̸ı���������淴Ӧ���ʽ��ͣ�ƽ�����淴Ӧ�ƶ���Ӧ�ǽ���ѹǿ��ƽ��ʱ�����ĺ������ͣ�
��3������������ԭ��Ӧ��������õ��������մɵ����������ɰ�����
��4��25��ʱ��pH=a�İ�ˮ��pH=1������������ϣ�ǡ����ȫ��Ӧ������Һ���Ϊ1L����n��NH3��H2O��=n��HCl�������ݰ�ˮ������������Ũ�ȼ�������һˮ�ϰ�������������¶���ԭ��ˮ����İٷ�����
��� �⣺��1���ٷ�Ӧ��ʼ��5min�ڣ�����NH3��ƽ����Ӧ����Ϊ$\frac{0.08mol/L}{5min}$=0.016mol/��L��min�����ɷ���ʽ��֪������Ũ�ȱ仯��Ϊ0.2mol/L��$\frac{3}{2}$=0.3mol/L��������ת����Ϊ$\frac{0.3mol/L}{\frac{2.6mol}{2L}}$��100%=23.1%��
N2��g��+3H2��g��?2NH3��g��
��ʼ����mol/L����0.5 1.3 0
�仯����mol/L����0.1 0.3 0.2
ƽ������mol/L����0.4 1 0.2
ƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{0��{2}^{2}}{0.4��{1}^{3}}$=0.1��
�ʴ�Ϊ��0.016mol/��L��min����23.1%��0.1��
��A������������������䣬�����ݻ����䣬�����ڵ������ܶ�ʼ�ձ��ֲ��䣬��A����
B���淴Ӧ���л���������ʵ�����С�����º�����ѹǿ��С�������ڵ�����ѹǿ���ֲ���˵������ƽ�⣬��B��ȷ��
C��ƽ��ʱ����ֵ�Ũ��֮�Ȳ�һ�����ڻ�ѧ������֮�ȣ�����ʼŨ�ȡ�ת�����йأ���C����
D����λʱ��������a molN2��������3molH2��ͬʱ����3amolH2����������������������������ȣ���Ӧ����ƽ�⣬��D��ȷ��
��ѡ��BD��
��������ƽ����ϵ�г���l mol N2��2.5molH2��0.5mol NH3������Ũ����Qc=$\frac{��0.2+\frac{0.5}{2}��^{2}}{��0.4+\frac{1}{2}������1+\frac{2.5}{2}��^{3}}$��K=0.1���ʷ�Ӧ������Ӧ���У�
�ʴ�Ϊ�������ƶ���
��2���ϳɰ����������С�ķ��ȷ�Ӧ��t1ʱ�̸ı���������淴Ӧ��������ƽ����Ӧ�ƶ���Ӧ�������¶ȣ����µ���ƽ������������ͣ�t3ʱ�̸ı���������淴Ӧ��������ƽ�ⲻ�ƶ��������ĺ������䣬Ӧ�Ǽ��������t4ʱ�̸ı���������淴Ӧ���ʽ��ͣ�ƽ�����淴Ӧ�ƶ���Ӧ�ǽ���ѹǿ��ƽ��ʱ�����ĺ������ͣ���t0��t1�ΰ���������������
�ʴ�Ϊ�������¶ȣ�t0��t1�Σ�
��3������������ԭ��Ӧ��������õ��������մɵ����������ɰ������õ��������ĵ缫��ӦʽΪ��N2+6H++6e-�T2NH3��
�ʴ�Ϊ��N2+6H++6e-�T2NH3��
��4��25��ʱ��pH=a�İ�ˮ��pH=1������������ϣ�ǡ����ȫ��Ӧ������Һ���Ϊ1L����n��NH3��H2O��=n��HCl��=1L��10-bmol/L=10-bmol����ˮ������������Ϊ1L��10-14+amol/L=10-14+amol��������һˮ�ϰ�Ϊ10-14+amol���ʸ��¶���ԭ��ˮ����İٷ���Ϊ$\frac{1{0}^{-14+a}}{1{0}^{-b}}$��100%=10��a+b-12��%��
��ѡ��A��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���Ӧ���ʼ��㡢ƽ��״̬�жϡ�ƽ�ⳣ��Ӧ�á����ԭ����������ʵ���ȣ���Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�

 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д�| ʱ�䣨min�� Ũ�ȣ�mol•L-1�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| A�� | �����в����ͼ� | |
| B�� | �������������л�����ȫȼ��ʱ��������������������� | |
| C�� | ���ܷ����ӳɷ�Ӧ��ȡ����Ӧ��������Ӧ | |
| D�� | ���в�ͬ�Ĺ����� |


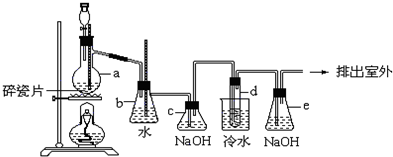
 ��50mL 0.50mol/L��������50mL 0.55mol/L������������Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺?
��50mL 0.50mol/L��������50mL 0.55mol/L������������Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺?