题目内容
1.雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得
各物质的浓度如下:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是bc (填
字母).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q<(填“>”、“=”或“<”)0.
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图所示:

①由图甲可知,SCR技术中的氧化剂为NO、NO2.已知c(NO2):c(NO)=1:1时脱氮效果最佳,
若生成1mol N2时反应放出的热量为Q kJ.此时对应的脱氮反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2QkJ•mol-1
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相
应的温度分别为Mn、200℃左右.
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
分析 (1)①分析图表数据结合化学反应速率概念计算v=$\frac{△c}{△t}$,计算平衡浓度结合平衡常数概念是生成物浓度的幂次方乘积除以反应物的幂次方乘积得到;
②反应前后是气体体积不变的反应,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度,或加入一氧化氮达到新平衡后个物质浓度增大;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,根据Qc与K的相对大小判断平衡移动方向,逆反应方向是吸热反应,正反应为放热反应;
(2)①得电子化合价降低的反应物是氧化剂;根据生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量;
②温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氢即可;
(3)常温下,测得某纯CaSO3与水形成的浊液pH为9,由可知CaSO3(s)?Ca2+(aq)+SO32-(aq),且SO32-+H2O?HSO3-+OH-,由Ka2(H2SO3)=6.0×10-9可知SO32-+H2O?HSO3-+OH-的水解Kh=$\frac{1{0}^{-14}}{6×1{0}^{-9}}$=1.67×10-4,以此计算c(SO32-),溶液中c(Ca2+)=c(SO32-)+c(HSO3-),结合Ksp(CaSO3)=c(Ca2+)×c(SO32-)计算.
解答 解:(1)①分析图表数据,0~10min内,NO的平均反应速率v(NO)=$\frac{1mol/L-0.58mol/L}{10min}$=0.042 mol/(L•min),
化学平衡三段式列式计算平衡浓度:
C(s)+2NO(g)?N2(g)+CO2(g);
起始量(mol/L) 1 0 0
变化量(mol/L) 0.6 0.3 0.3
平衡量(mol/L) 0.4 0.3 0.3
K=$\frac{0.3×0.3}{0.{4}^{2}}$=$\frac{9}{16}$;
故答案为:0.042 mol/(L•min);$\frac{9}{16}$;
②30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大;
a.加入一定量的活性炭是固体,对平衡无影响,故a不符合;
b.通入一定量的NO,反应正向进行,达到平衡后一氧化氮、氮气、二氧化碳浓度增大,故b符合;
c.适当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但个物质浓度增大,符合要求,故c符合;
d.加入合适的催化剂,只能改变化学反应速率,不能改变平衡,浓度不变,故d不符合;
故答案为:bc;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,Qc=$\frac{3×3}{{5}^{2}}$<$\frac{9}{16}$,这说明升高温度平衡向逆反应方向移动,因此逆反应是吸热反应,则正反应是放热反应,故Q<0,故答案为:<;
(2)①由图甲可知SCR技术中NH3与NO、NO2反应产物为N2和水,故氧化剂为NO、NO2;脱氮效果最佳时c(NO2):c(NO)=1:1,因此反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2 (g)+3H2O(g)△H=-2Q kJ•mol-1;故答案为:NO、NO2;2NH3(g)+NO(g)+NO2(g)=2N2 (g)+3H2O(g)△H=-2Q kJ•mol-1;
②根据图乙知Mn催化剂时,在200℃左右脱氮率最高,Cr作催化剂,500℃左右脱氮率最高,但二者的最高脱氮率差不多,使用Mn作催化剂需要的温度低,更经济,因此使用的最佳的催化剂和相应的温度分别为Mn、200℃左右;故答案为:Mn、200℃左右;
(3)由Ka2(H2SO3)=6.0×10-9可知SO32-+H2O?HSO3-+OH-的水解Kh=$\frac{1{0}^{-14}}{6×1{0}^{-9}}$=1.67×10-4,
常温下,测得某纯CaSO3与水形成的浊液pH为9,c(HSO3-)=c(OH-)=1×10-5,
可知c(SO32-)=$\frac{(1×1{0}^{-5})^{2}}{1.67×1{0}^{-4}}$=6×10-5,
又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5,
Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9,
故答案为:4.2×10-9.
点评 本题考查了化学平衡常数和反应速率概念计算应用,平衡标志的分析判断,以及弱电解质的电离与溶解平衡的计算等,掌握基础是关键,题目难度中等.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)③的单质在空气中充分燃烧的化学方程式是4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O.④与⑥形成的稳定化合物的电子式为
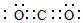 .
.(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为NH4NO3,其中含有的化学键为离子键和共价键.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈黄色.⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | BrCH2CH2Br 二溴乙烷 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-1-丁烯 2-甲基-1-丁烯 |
| 反应 | △H(kJ•mol-1) | 平衡常数K |
| ①4NH3(g)+5O2(g)?4NO(g)+6H2O(g) | -907 | 1.1×1026 |
| ②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g) | -1105 | 4.4×1028 |
| ③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g) | -1269 | 7.1×1034 |
| A. | N2(g)+O2(g)=2NO(g)△H=362 kJ•mol-1 | |
| B. | 增大压强,则反应②的K 不变,反应①和③的K 减小 | |
| C. | 500℃,2N2O(g)+O2(g)?4 NO(g) K=4×102 | |
| D. | 使用合适的催化剂可提高反应的选择性,提高NO 的产出率 |
| A. |  用图所示装置进行石油的分馏 | |
| B. |  实验室制取乙酸乙酯 | |
| C. |  用图所示装置萃取碘水中的碘 | |
| D. |  检验溴乙烷与NaOH乙醇溶液共热产生乙烯 |

| A. | 其中的离子交换膜需选用阴离子交换膜 | |
| B. | 阴极的电极反应式为:2HSO3-+2e-=S2O42-+2OH- | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 反应一段时间后将惰性电极换成铁电极,对电极产物不产生影响 |
| A. | 铜反应与浓硝酸 | B. | 钠与水反应 | ||
| C. | 液氨汽化 | D. | Ba(OH)2•8H2O与NH4Cl固体的反应 |
| A. | NaHSO4溶液与Ba(OH)2溶液混合 | B. | HNO3溶液与澄清石灰水混合 | ||
| C. | NH4Cl溶液与KOH溶液混合 | D. | Na2HPO4溶液与NaOH溶液混合 |