题目内容
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺流程如下:

Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:

Ⅱ.有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液后过滤得到的滤渣中主要含有________(填写化学式)。25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8 时,c(Mg2+)∶c(Fe3+)=________。
(2)操作X为________,其温度应控制在_____________________________________
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由______________________________
________________________________________________________________________。
(1)Fe(OH)3、Mg(OH)2、CaCO3(前两个必填) 2.125×1021
(2)趁热过滤 36℃以上
(3)不可行 若“母液”循环使用,则溶液中c(Cl-)和c(SO42—)增大,最后所得产物Na2CO3中混有杂质
【解析】(1)碳酸钠与Ca2+、Mg2+、Fe3+可直接反应生成CaCO3、MgCO4、Fe(OH)3沉淀,加入NaOH溶液后,MgCO3进一步转化成Mg(OH)2沉淀。混合溶液的pH=8 时,c(OH-)=10-6mol·L-1,c(Mg2+)∶c(Fe3+)= =2.125×1021。(2)操作X是将Na2CO3·H2O过滤出来,结合题图中碳酸钠的饱和溶液在不同温度下析出的溶质不同可知,需在高于36 ℃温度下趁热过滤。(3)若“母液”循环使用,则溶液中c(Cl-)和c(SO42—)增大,最后所得产物Na2CO3中混有杂质,该操作不可行。
=2.125×1021。(2)操作X是将Na2CO3·H2O过滤出来,结合题图中碳酸钠的饱和溶液在不同温度下析出的溶质不同可知,需在高于36 ℃温度下趁热过滤。(3)若“母液”循环使用,则溶液中c(Cl-)和c(SO42—)增大,最后所得产物Na2CO3中混有杂质,该操作不可行。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案某小组取一定质量的FeSO4固体,利用下图装置进行实验。

实验 | 实验过程 | 实现现象 |
① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_____________________________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是____________________________________________________
(3)实验④反应的离子方程式是_____________________________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________________________________________(用必要的文字和化学方程式解释)。
温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g) C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间 | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
A的物质的量浓度(mol·L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
B的物质的量浓度(mol·L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
D的物质的量浓度(mol·L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=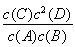
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
某小组查文献得知:氧化性I >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2
 S4
S4 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1 )。
)。
Ⅰ.该小组为确定一份加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)的成分,设计定性实验加以猜想和验证。
(1)实验过程如下:
实验步骤 | 实验过程和现象 | 对应结论 | |
步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 |
_____________ | |
步 骤 2 | 第①份 试液 |
| 碘盐中肯定含 |
第②份 试液 |
|
_____________ | |
第③份 试液 |
| X为 (填化学式) | |
(2)该碘盐中肯定不含的物质是 (用化学式或离子符号表达)。
(3)根据信息推断Fe3+、S4 、I2、Br2的氧化性由强到弱的顺序是 。
、I2、Br2的氧化性由强到弱的顺序是 。
(4)第③份试液中加入足量KI固体后,反应的离子方程式为 、 。
Ⅱ.用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:
取0.40 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。加入淀粉作滴定指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
(1)滴定终点的现象是 。
(2)CuCl2溶液与KI反应的化学方程式为 。
(3)该试样中CuCl2·2H2O的质量分数为 。