题目内容
1.下列有关化学用语表示正确的是( )| A. | 乙酸的结构简式:C2H4O2 | B. | MgCl2的电子式: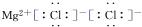 | ||
| C. | 中子数为8的碳原子:${\;}_{6}^{8}$C | D. | F-的结构示意图: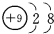 |
分析 A.结构简式中应该标出乙酸的官能团结构;
B.两个氯离子应该写在镁离子的两边;
C.元素符号的左上角为质量数,质量数=质子数+中子数;
D.氟离子的核电荷数为9,核外电子总数为10.
解答 解:A.乙酸分子中含有1个羧基,正确的结构简式为:CH3COOH,故A错误;
B.氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为 ,故B错误;
,故B错误;
C.中子数为8的碳原子的质量数为14,该原子正确的表示方法为:614C,故C错误;
D.F-的核电荷数为9,最外层满足8电子稳定结构,其离子结构示意图: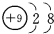 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、结构简式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为____________.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为_______________(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
微粒 | EO2﹣ | EO3﹣ |
立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是____________.
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
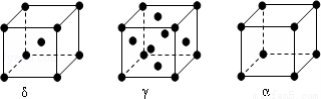
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为____________,δ、γ、α三种晶胞的边长之比为____________。
| A. | O2-、F-、Na+、Mg2+ | B. | Na+、Mg2+、S2-、Cl- | ||
| C. | F-、Cl-、Br-、I- | D. | Na+、Mg2+、K+、Ca2+ |
| A. | H2O2既是氧化剂又是还原剂 | |
| B. | FeCl3对H2O2的分解起催化作用 | |
| C. | 使用FeCl2代替FeCl3,不能起到催化作用 | |
| D. | 反应过程中有Fe2+生成 |
| A. | C12与水反应 C12+H2O═2 H++C1-+ClO- | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 碳酸氢钠溶液与足量盐酸反应:HCO3-+H+═H2O+CO2↑ |
| A. | 水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、Ba2+、Cl-、NO3- | |
| B. | 使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO- | |
| D. | 在FeCl3溶液中:K+、Na+、SO42-、AlO2- |