题目内容
3.中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出).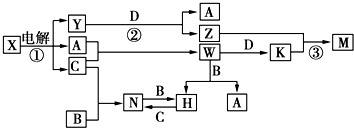
已知:A、B、C、D是单质,其余是化合物,其中B、D是常见金属,且组成B的元素属于过渡元素.又知A在C中点燃有苍白色火焰,M既可溶于盐酸又可溶于NaOH溶液.请回答下列问题:
(1)W的电子式是
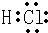 .
.(2)写出N的化学式:FeCl3,写出B元素在周期表中的位置第四周期第VIII族.
(3)写出下列反应的离子方程式:反应①2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cl2↑+2H2↑+2OH-.反应③3AlO2-+Al3++6H2O=4Al(OH)3↓.
K溶液和过量氨水反应Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
分析 A在C中点燃有苍白色火焰,应为H2在Cl2中的燃烧,则A为H2,C为Cl2,W为HCl,应为电解饱和食盐水的反应,则X为饱和NaCl溶液,Y为NaOH,B、D是常见金属,且组成B的元素属于过渡元素,M既可溶于盐酸又可溶于NaOH溶液,能与NaOH反应生成H2的金属为Al,则D为Al,Z为NaAlO2,K为AlCl3,M为Al(OH)3,由转化关系可知B应为变价金属,应为Fe,则N为FeCl3,H为FeCl2,结合物质的性质以及题目的要求解答该题.
解答 解:A在C中点燃有苍白色火焰,应为H2在Cl2中的燃烧,则A为H2,C为Cl2,W为HCl,应为电解饱和食盐水的反应,则X为饱和NaCl溶液,Y为NaOH,B、D是常见金属,且组成B的元素属于过渡元素,M既可溶于盐酸又可溶于NaOH溶液,能与NaOH反应生成H2的金属为Al,则D为Al,Z为NaAlO2,K为AlCl3,M为Al(OH)3,由转化关系可知B应为变价金属,应为Fe,则N为FeCl3,H为FeCl2,
(1)W为HCl,W的电子式是 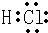 ,
,
故答案为: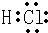 ;
;
(2)根据上面的分析可知,N为FeCl3,B为Fe,铁元素在周期表中的位置是第四周期第VIII族,
故答案为:FeCl3;第四周期第VIII族;
(3)反应①的离子方程式为2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2Cl2↑+2H2↑+2OH-,反应③的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,K为AlCl3,K溶液和过量氨水反应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2Cl2↑+2H2↑+2OH-;3AlO2-+Al3++6H2O=4Al(OH)3↓;Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
点评 本题考查无机物的推断,题目难度中等,根据物质的典型性质,明确物质的种类为解答该题的关键,题中注意以A在C中点燃有苍白色火焰为突破口,注意工业电解饱和食盐水的重要应用.

| 时间(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
| 0 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
| 第8min | 0.1 | 2.0 | 1.8 |
| 第9min | 0.05 | 1.9 | 0.3 |
(1)第2min到第4min内A的平均反应速率v(A)=0.1mol•L-1•min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、6min时分别改变了某一个反应条件,则改变的条件分别可能是:①第 2min使用催化剂、升高温度;②第 6min增加B的浓度;
(3)反应在第4min建立平衡,此温度下该反应的化学平衡常数 K=2.22.
(4)判断第9min时否(是/否)达平衡,说明理由因为Qc<K.
| A. | 酸性高锰酸钾溶液 | B. | 溴化钾溶液 | ||
| C. | 溴水 | D. | 硝酸银溶液 |
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”),升高温度,逆反应速率增大(填“增大”、“减小”或“不变”)
(3)温度不变,减小CO浓度,平衡向正反应方向移动(填“正反应”或“逆反应”),该反应平衡常数K 值不变(填“增大”、“减小”或“不变”)
(4)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO)=1mol•L-1,c(H2O)=3mol•L-1,c(CO2)=1mol•L-1,c(H2)=5mol•L-1,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”)
(5)t℃时,在2L的固定容积的密闭容器中放入4mol CO2和6mol H2,平衡后CO2的转化率为60%,则达到平衡时CO的体积分数为24%,反应温度t为830℃.
温度不变,若起始时投入3.6mol CO、3.6mol H2O和1.8mol H2,则达到平衡时CO的体积分数为24%,H2的平衡浓度为1.62mol/L.
①H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ•mol-1
②CO2(g)+C5(s)+2H+(aq)═2C3+(s)+H2O(l)+$\frac{1}{2}$O2(g)△H=+396kJ•mol-1
③12C3+(s)+12e-+6H2O(l)═C6H12O6(葡萄糖,s)+6C5(s)△H=-1200kJ•mol-1
下面关于绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式正确的是( )
| A. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=-1880 kJ•mol-1 | |
| B. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2880 kJ•mol-1 | |
| C. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2560 kJ•mol-1 | |
| D. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=-1720 kJ•mol-1 |
| A. | 尼古丁是由26个原子构成的物质 | |
| B. | 尼古丁中C、H、N 三种元素的质量比为:10:14:2 | |
| C. | 尼古丁的相对分子质量是162g | |
| D. | 尼古丁中氮元素的质量分数为17.3% |
| A. | 水分子是一种极性分子,水分子空间结构呈直线型 | |
| B. | H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键 | |
| C. | 水分子间通过H-O键形成冰晶体 | |
| D. | 冰晶胞中水分子的空间排列方式与干冰胞类似 |
| A. | 铜→氧化铜 | B. | 氢氧化钙→氢氧化钠 | ||
| C. | 铜→碳酸铜 | D. | 碳酸钙→氯化钙 |
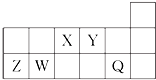
| A. | X与Y可以形成5种以上的化合物 | |
| B. | Y分别与Z、W形成的化合物的晶体类型相同 | |
| C. | 工业上常用电解法生产Z、Q的单质 | |
| D. | 简单气态氢化物的热稳定性:Y>X>W |