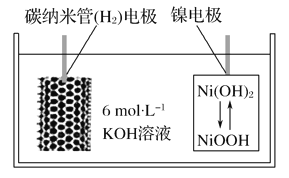
题目内容
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
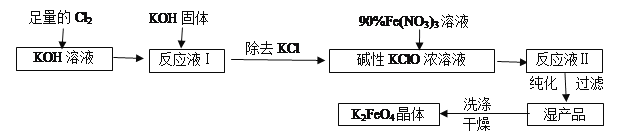
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式___________。
(2)在溶液Ⅰ中加入KOH固体的目的是________(填编号)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为________。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为________mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体)+ O2↑+ OH-。___________
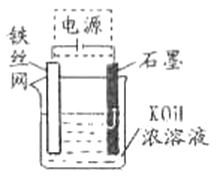
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为_____________。
【答案】 2OH-+Cl2=ClO-+Cl-+H2O AC 2Fe3++3C1O-+10OH-=2FeO42-+3Cl-+5H2O 0.45 4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+3O2↑+8OH- Fe+8OH--6e-=FeO42-+4H2O
4Fe(OH)3(胶体)+3O2↑+8OH- Fe+8OH--6e-=FeO42-+4H2O
【解析】足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,Cl2+H2O=H++Cl-+HClO,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4,
(1)KOH溶液和足量Cl2发生反应生成KCl、KClO和H2O,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,Cl2+H2O=H++Cl-+HClO;(2)KOH和氯气反应生成KClO,除去未反应的氯气,且只有碱性条件下,铁离子才能和次氯酸根离子发生氧化还原反应生成高铁酸根离子,所以加入KOH的目的是除去氯气且使溶液为碱性,故选AC;(3)反应③中铁离子和次氯酸根粒子发生氧化还原反应生成高铁酸根离子,离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;n(K2FeO4)=59.4g/198g·mol-1=0.3mol,根据2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O知,氧化剂的物质的量=0.3mol×3/2=0.45mol。(4)该反应中Fe元素化合价由+6价变为+3价、O元素化合价由-2价变为0价,其转移电子数为6,根据转移电子相等、电荷守恒配平方程式为4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,故系数为:4;10;4;3;8。(5)在碱性条件下,铁失去电子被氧化,阳极的电极反应式为Fe+8OH--6e-=FeO42-+4H2O。

【题目】某校化学兴趣小组对以下三种品牌牙膏中摩擦剂成分进行调查,结果如下表:
牙膏品牌 | A儿童牙膏 | B防臭牙膏 | C透明牙膏 |
摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
(1)上述三种摩擦剂成分中属于酸性氧化物的是________(填化学式,下同);既能与强酸反应又能与强碱反应的是________。
(2)A儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是______________________________。
(3)从摩擦剂成分考虑,向B防臭牙膏样品中滴加少量稀盐酸,可观察到的现象是______________________________________,该反应的化学方程式为_______________________。
(4)C透明牙膏摩擦剂成分SiO2是工业制备晶体硅的原料,其反应原理是_______________(用化学反应方程式表示)。