题目内容
12.已知反应:N2(g)+O2(g)═2NO(g)△H1
2H2(g)+O2(g)═2H2O(g)△H2
N2(g)+3H2(g)═2NH3(g)△H3
利用上述三个反应,计算4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H4的反应焓变为2△H1+3△H2-2△H3(用含△H1、△H2、△H3的式子表示).
分析 由①N2(g)+O2(g)═2NO(g)△H1
②2H2(g)+O2(g)═2H2O(g)△H2
③N2(g)+3H2(g)═2NH3(g)△H3
结合盖斯定律可知,①×2+②×3-③×2可得4NH3(g)+5O2(g)═4NO(g)+6H2O(g),以此计算.
解答 解:由①N2(g)+O2(g)═2NO(g)△H1
②2H2(g)+O2(g)═2H2O(g)△H2
③N2(g)+3H2(g)═2NH3(g)△H3
结合盖斯定律可知,①×2+②×3-③×2可得4NH3(g)+5O2(g)═4NO(g)+6H2O(g),
则△H4=2△H1+3△H2-2△H3,
故答案为:2△H1+3△H2-2△H3.
点评 本题考查反应热与焓变,为高频考点,把握已知反应与目标反应的关系、盖斯定律应用等为解答的关键,侧重分析与计算能力的考查,注意焓变的关系,题目难度不大.

练习册系列答案
相关题目
5.部分短周期元素的有关信息如表所示
根据表中信息,判断以下叙述正确的是( )
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Z | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
20.某些化学键的键能数据如下表:
反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的焓变△H=-178kJ/mol,△S<0(填>,<,=)
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
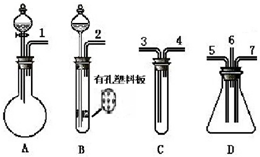 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示: