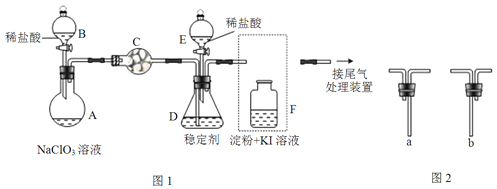
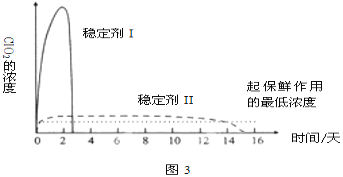
题目内容
【题目】(1)请用热化学方程式表示:
①1mol N2(g)与适量O2(g)起反应,生成2 mol NO2(g),吸收68kJ热量。___________
②4g CO在氧气中燃烧生成CO2,放出9. 6kJ热量_____________________________________
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为_________________________________________________。
②又已知![]() ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_________。
【答案】![]()
![]()
![]() N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol 408.875 产物不会造成环境污染
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol 408.875 产物不会造成环境污染
【解析】
(1)①1mol N2(g)与适量O2(g)起反应,生成2mol NO2(g),吸收68kJ热量的热化学方程式为N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;
②4g CO在氧气中燃烧生成CO2,放出 9.6kJ热量,28g一氧化碳在氧气中燃烧放出热量=![]() ×9.6kJ=67.2kJ,则CO燃烧的热化学方程式为:CO(g)+
×9.6kJ=67.2kJ,则CO燃烧的热化学方程式为:CO(g)+![]() O2(g)=CO2(g)△H=-67.2kJ/mol;
O2(g)=CO2(g)△H=-67.2kJ/mol;
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①0.4mol液态肼放出256.7kJ的热量,则1mol液态肼放出的热量为256.7kJ×![]() ==641.75kJ,所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol;
==641.75kJ,所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol;
②①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75kJ/mol,则16g液态肼即![]() =0.5mol与液态双氧水反应生成液态水时放出的热量817.75kJ/mol×0.5mol=408.875kJ;
=0.5mol与液态双氧水反应生成液态水时放出的热量817.75kJ/mol×0.5mol=408.875kJ;
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分,对环境无危害,不会造成环境污染。

【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
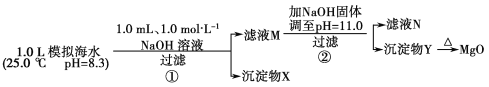
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
【题目】汽车尾气中含有CO、NO等有害气体。
(1)通过NO传感器可监测汽车尾气中NO的含量其工作原理如图所示。已知:![]() 可在固体电解质中自由移动。
可在固体电解质中自由移动。
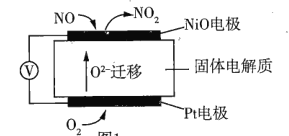
①NO电极上发生的是______(填“氧化”或“还原”)反应。
②外电路中,电子是从______(填“NO”或Pt”)电极流出。
③Pt电极上的电极反应式为______。
(2)一种新型催化剂用于NO和CO的反应:![]() 。已知增大催化剂的比表面积可提高该反应的速率,为了验证温度、催化剂的比表面积对化学反应速率的影响,某同学设计了三组实验,如表所示。
。已知增大催化剂的比表面积可提高该反应的速率,为了验证温度、催化剂的比表面积对化学反应速率的影响,某同学设计了三组实验,如表所示。
实验编号 |
| NO初始浓度/( | CO初始浓度/( | 催化剂的比表面积( |
Ⅰ | 280 |
|
| 82 |
Ⅱ | 280 |
|
| 124 |
Ⅲ | 350 | a |
| 82 |
①表中a=______。
②能验证温度对化学反应速率影响的是实验______(填实验序号)。
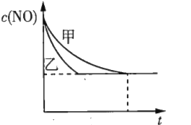
③实验I和实验Ⅱ中,NO的物质的量浓度![]() 随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线______(填“甲”或“乙”)。
随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线______(填“甲”或“乙”)。
(3)在容积固定的绝热容器中发生反应![]() ,不能说明该反应已达到平衡状态的是______(填序号)。
,不能说明该反应已达到平衡状态的是______(填序号)。
A.容器内温度不再变化 B.容器内的气体压强保持不变
C.![]() D.容器内混合气体的密度保持不变
D.容器内混合气体的密度保持不变
【题目】下列物质的用途是利用其物理性质的是
选项 | 物质 | 用途 |
A | 四氢噻吩( | 作为杂质气体添加到家用天然气中,警示气体泄漏 |
B | 铁粉 | 装入透气纸袋中,用于富脂食品包装袋中 |
C | KMnO4 | 浸泡硅藻土,用作新鲜水果的保鲜剂 |
D | K2Cr2O7 | 用于酒驾检测仪中,检验司机是否酒驾 |
A.AB.BC.CD.D