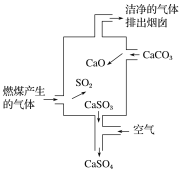
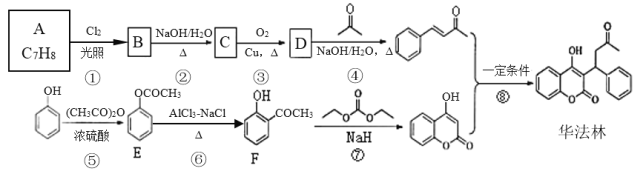
题目内容
【题目】ClO2与Cl2的氧化性相近.在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
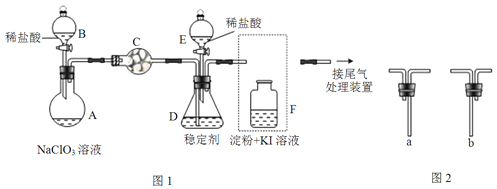
(1)仪器C的名称是__。安装F中导管时,应选用图2中的__。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.该反应中氧化剂与还原剂物质的量之比为__,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___。
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是__,原因是__。
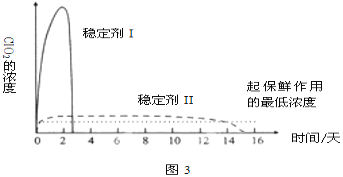
【答案】干燥管 b 1:1 慢 吸收Cl2 4H++5ClO2-=Cl-+4ClO2↑+2H2O 验证是否有ClO2生成 稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度
【解析】
ClO2与Cl2的氧化性相近,稀盐酸和NaClO3溶液发生反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,生成ClO2和Cl2气体进入干燥管中,D中加入稳定剂使ClO2在D中被稳定剂充分吸收。
(1)根据仪器特征,仪器C的名称是干燥管;根据操作分析,F装置应是Cl2和KI反应,所以应该长管进气,短管出气,答案选b。
(2)根据反应方程式可知,NaClO3中氯元素化合价由+5价降低到+4价,HCl中氯元素化合价由-1价升高到0价,故NaClO3作氧化剂,HCl作还原剂,根据得失电子守恒可知,氧化剂与还原剂物质的量之比为1:1;为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度要慢。
(3)F装置中能发生Cl2+2KI=2KCl+I2,碘遇淀粉变蓝,所以若F中溶液的颜色若不变,说明没有氯气,则装置C的作用是吸收Cl2。
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据化合价升降相等和电荷守恒以及原子守恒配平,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O;在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成。
(5)根据图3可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好。

【题目】一定温度下进行反应:COCl2(g)![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是
A.0~4s容器内的压强逐渐增大
B.生成Cl2的平均反应速率,0~2s比2~4s快
C.8s时向容器中再充入一定量的氦气,反应速率又会加快
D.该条件下,COCl2的最大转化率为40%