题目内容
如图所示:
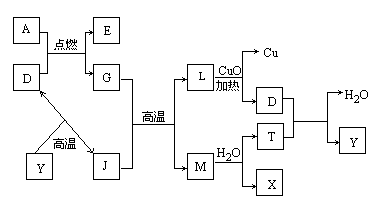
其中A、G是固体单质,其余是化合物.X是常用于切割和焊接金属的可燃性气体;Y是一种难溶于水的白色固体,它的式量是100.
请填空:
(1)D的电子式是________.
(2)A跟D反应的化学方程式是________;
该反应的反应热ΔH________0(填“<、=、>”).
(3)在高温条件下,G跟J反应的化学方程式是________.
解析:
|
(1) (2)2Mg+CO2 (3)CaO+3C |

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O  C6H12O6+6O2 b .CO2+3H2?
C6H12O6+6O2 b .CO2+3H2?  CH3OH+H2O
CH3OH+H2O
c.CO2+CH4  CH3COOH d. 2CO2+6H2
CH3COOH d. 2CO2+6H2  CH2==CH2+4H2O
CH2==CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
|
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) ![]() 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
|
图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为 。
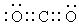
 2MgO+C,小于
2MgO+C,小于 CaC2+CO↑
CaC2+CO↑