题目内容
A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:
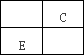
请回答:
(1)D、E组成的常见的化合物,其水溶液呈碱性,原因是________(用离子方程式表示).
(2)E的单质能跟D的最高价氧化物对应水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式________.
(3)C、F所形成的化合物为离子化合物,其晶体结构模型如下:
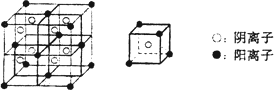
该离子化合物的化学式为________.
(4)4.0 g E的单质在足量的B的单质中完全燃烧,放出37.0 kJ热量,写出其热化学方程式:____________________.
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH浓溶液,两极均有特制的防止气体透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的________极;B极的电极反应式是________.
答案:
解析:
解析:
(1)S2-+H2O=HS-+OH-
(2)3S+6OH-=2S2-+SO32-+3H2O
(3)CaF2
(4)S(s)+O2(g)![]() SO2(g);ΔH=-296 kJ/mol
SO2(g);ΔH=-296 kJ/mol
(5)负 O2+4e-+2H2O![]() 4OH-
4OH-

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.