题目内容
8.34g FeSO4?7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示.请回答下列问题:
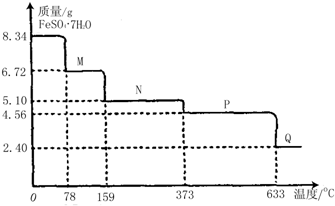
(1)试通过计算确定78℃时固体物质M的化学式为 .(要求写出计算过程)
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成且两种气体的组成元素相同、相对分子质量相差16,写出该反应的化学方程式 .
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响).
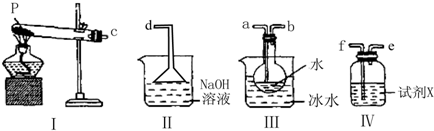
①试剂X的名称是 .
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ .
③充分反应后,利用装置Ⅲ中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止.若最终得到沉淀的质量为W g,则已分解的P的质量为 g (列出计算式即可).

(1)试通过计算确定78℃时固体物质M的化学式为
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成且两种气体的组成元素相同、相对分子质量相差16,写出该反应的化学方程式
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响).

①试剂X的名称是
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→
③充分反应后,利用装置Ⅲ中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止.若最终得到沉淀的质量为W g,则已分解的P的质量为
考点:探究物质的组成或测量物质的含量,铁及其化合物的性质实验
专题:实验探究和数据处理题
分析:(1)依据图象数据和绿矾加热失去结晶水质量变化计算分析判断;
(2)依据隔绝空气加热至650℃,得到一种红棕色的物质Q,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16判断生成产物为氧化铁,二氧化硫,三氧化硫.原子守恒配平化学方程式;
(3)①剩余的二氧化硫污染空气需要吸收;
②依据分解产物中的气体为二氧化硫和三氧化硫,三氧化硫沸点较低冷却后变为液体,二氧化硫可以利用其还原性、漂白性选择试剂验证;
③装置Ⅲ中圆底烧瓶内是三氧化硫,加入氯化钡全部反应生成硫酸钡沉淀,根据沉淀质量计算物质的量,结合化学方程式计算分解的硫酸亚铁质量;
④测得已分解的P的质量比实际分解质量要小可能是装置中的气体为被赶净到Ⅱ、Ⅲ中;
(2)依据隔绝空气加热至650℃,得到一种红棕色的物质Q,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16判断生成产物为氧化铁,二氧化硫,三氧化硫.原子守恒配平化学方程式;
(3)①剩余的二氧化硫污染空气需要吸收;
②依据分解产物中的气体为二氧化硫和三氧化硫,三氧化硫沸点较低冷却后变为液体,二氧化硫可以利用其还原性、漂白性选择试剂验证;
③装置Ⅲ中圆底烧瓶内是三氧化硫,加入氯化钡全部反应生成硫酸钡沉淀,根据沉淀质量计算物质的量,结合化学方程式计算分解的硫酸亚铁质量;
④测得已分解的P的质量比实际分解质量要小可能是装置中的气体为被赶净到Ⅱ、Ⅲ中;
解答:
解:(1)依据图象分析在78℃时固体质量变为6.72g,绿矾加热失去结晶水,质量减小,
设失去结晶水x个,则8.34g FeS04?7H20样品物质的量=
=0.03mol,
FeSO4?7H2O
FeSO4?(7-x)H2O+xH2O
0.03mol 0.03xmol
依据加热分解减少的是水的质量列式:0.03xmol×18g/mol=8.34g-6.72g=1.62g
x=3
所以加热到78℃时固体为FeSO4?4H2O,
故答案为:FeSO4?4H2O;
(2)晶体全部失去结晶水得到固体质量为8.34g-0.03mol×7×18g/mol=4.56g;对应温度为633°C;取适量380℃时所得的样品P,隔绝空气加热至650℃,结晶水乙全部失去,硫酸亚铁受热分解得到一种红棕色的物质Q判断为Fe2O3,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16,判断为SO2,SO3,所以反应的化学方程式为:2 FeSO4
Fe2O3+SO2↑+SO3↑;
故答案为:2 FeSO4
Fe2O3+SO2↑+SO3↑;
(3)①试剂X的名称可以是利用二氧化硫的漂白性选择品红溶液验证;
故答案为:品红溶液;
②中生成的气态物质为二氧化硫和三氧化硫气体,三氧化硫沸点较低冷却后变为液体,二氧化硫可以利用其还原性、漂白性选择试剂验证,剩余的二氧化硫污染空气需要吸收;装置连接顺序为:c→a→b→f→e→d,
故答案为:a→b→f→e→d;
③第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止.若最终得到沉淀的质量为W g,沉淀为硫酸钡,依据硫元素守恒结合化学方程式定量关系可知,
2FeSO4~SO3~BaSO4
2 1
n(FeSO4)
已分解的硫酸亚铁物质的量为
,
质量=
×152g/mol=
g
故答案为:
g;
设失去结晶水x个,则8.34g FeS04?7H20样品物质的量=
| 8.34g |
| 278g/mol |
FeSO4?7H2O
| ||
0.03mol 0.03xmol
依据加热分解减少的是水的质量列式:0.03xmol×18g/mol=8.34g-6.72g=1.62g
x=3
所以加热到78℃时固体为FeSO4?4H2O,
故答案为:FeSO4?4H2O;
(2)晶体全部失去结晶水得到固体质量为8.34g-0.03mol×7×18g/mol=4.56g;对应温度为633°C;取适量380℃时所得的样品P,隔绝空气加热至650℃,结晶水乙全部失去,硫酸亚铁受热分解得到一种红棕色的物质Q判断为Fe2O3,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16,判断为SO2,SO3,所以反应的化学方程式为:2 FeSO4
| ||
故答案为:2 FeSO4
| ||
(3)①试剂X的名称可以是利用二氧化硫的漂白性选择品红溶液验证;
故答案为:品红溶液;
②中生成的气态物质为二氧化硫和三氧化硫气体,三氧化硫沸点较低冷却后变为液体,二氧化硫可以利用其还原性、漂白性选择试剂验证,剩余的二氧化硫污染空气需要吸收;装置连接顺序为:c→a→b→f→e→d,
故答案为:a→b→f→e→d;
③第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止.若最终得到沉淀的质量为W g,沉淀为硫酸钡,依据硫元素守恒结合化学方程式定量关系可知,
2FeSO4~SO3~BaSO4
2 1
n(FeSO4)
| wg |
| 233g/mol |
已分解的硫酸亚铁物质的量为
| 2W |
| 233g/mol |
质量=
| 2W |
| 233g/mol |
| W×152×2 |
| 233 |
故答案为:
| W×152×2 |
| 233 |
点评:本题考查了图象分析计算,实验验证的装置连接原理,二氧化硫性质的应用,注意实验过程分析判断,掌握物质性质和数据分析是解题关键,题目难度较大.

练习册系列答案
相关题目
若N表示阿伏加德罗常数的数值,在3(NH4)2SO4
N2↑+4NH3↑+3S02↑++H2O的反应中,当有N个电子转移时,以下说法中错误的是( )
| ||
A、有
| ||
B、有
| ||
C、有
| ||
D、有
|
火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常用电解精炼法将粗铜提纯.在电解精炼时( )
| A、粗铜接电源负极 |
| B、精铜作阴极 |
| C、杂质都将以单质形式沉积到池底 |
| D、精铜片增重2.56g,电路中通过电子为0.04mol |
如图为正丁腈的结构简式,正丁腈为易燃液体,有毒性,下列有关说法正确的是( )


| A、同等条件下,正丁腈在水中的溶解度比在乙醚中的溶解度大 |
| B、其分子式为C4H7N,其密度比水大 |
| C、它还可被命名为氰代丙烷,正丙基氰等,其结构中不含氢键 |
| D、正丁腈由丁烯与氨氧化而得,或由丁醇与氨催化氧化而得 |

 有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.
有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.