题目内容
2. 25℃时,用0.01mol•L-1的氢氧化钠溶液滴定20mL同浓度的HA溶液,滴定曲线如图所示[AG=1g$\frac{c({H}^{+})}{c(O{H}^{-})}$].下列有关叙述正确的是( )
25℃时,用0.01mol•L-1的氢氧化钠溶液滴定20mL同浓度的HA溶液,滴定曲线如图所示[AG=1g$\frac{c({H}^{+})}{c(O{H}^{-})}$].下列有关叙述正确的是( )| A. | 由图可知HA为强酸 | |
| B. | 滴定终点应为于OA段之间 | |
| C. | A点对应溶液中:c(A-)=c(Na+) | |
| D. | 当滴入NaOH溶液10mL时,所得溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-) |
分析 A.由图可知,0.01mol/LHA的pH=6;
B.碱滴定酸,pH突变时溶液为碱性;
C.A点时AG=0,c(OH-)=c(H+),结合电荷守恒式c(A-)+c(OH-)=c(Na+)+c(H+)分析;
D.当滴入NaOH溶液10mL时,溶液中溶质为等量的NaA、HA,HA电离大于A-的水解.
解答 解:A.由图可知,0.01mol/LHA的pH=6,可知HA不能完全电离,则HA为弱酸,故A错误;
B.碱滴定酸,pH突变时溶液为碱性,则滴定终点应为于AB段之间,故B错误;
C.A点时AG=0,c(OH-)=c(H+),由电荷守恒式c(A-)+c(OH-)=c(Na+)+c(H+)可知c(A-)=c(Na+),故C正确;
D.当滴入NaOH溶液10mL时,溶液中溶质为等量的NaA、HA,HA电离大于A-的水解,则离子浓度为c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故D错误;
故选C.
点评 本题考查酸碱混合及滴定图象,为高频考点,把握AG的应用、混合溶液的溶质、电荷守恒为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
10. 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)图中表示NO2变化曲线的是b;在第5s时,NO的转化率为65%
(2)0~2s内用O2来表示该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1;
(3)能说明该反应已达到平衡状态的是BD
A.v(NO2)=2v(O2)
B.v (NO)逆=2v (O2)正
C.容器内密度保持不变
D.容器内压强保持不变.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)0~2s内用O2来表示该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1;
(3)能说明该反应已达到平衡状态的是BD
A.v(NO2)=2v(O2)
B.v (NO)逆=2v (O2)正
C.容器内密度保持不变
D.容器内压强保持不变.
11.下列说法错误的是( )
| A. | 一定条件下,苯酚可以和甲醛发生加聚反应生成酚醛树脂 | |
| B. | 聚丙烯酸钠属于功能高分子材料,具有较强的吸水性 | |
| C. | 酶是具有催化作用的蛋白质,在光、热、酸、碱、重金属离子、乙醇等作用下会失去活性 | |
| D. | 淀粉溶液、肥皂水都是胶体,都有丁达尔效应 |
8.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等.
现以硫酸渣制备铁红(Fe2O3),过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.检验Fe3+被完全还原的实验操作和现象是:取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3+已被完全还原.
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
(5)滤液B可以回收的物质有Al2(SO4)3、MgSO4、Na2SO4.
现以硫酸渣制备铁红(Fe2O3),过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.检验Fe3+被完全还原的实验操作和现象是:取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3+已被完全还原.
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
7. 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
①实验甲中,若2min 时测得放出的热量是4.2kJ,则0→2min时间内,用SO2(g)表示的平均反应速率υ(SO2)=0.05mol/(L•min)
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
| 实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(SO2) | n(NO2) | n(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T2 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
14.α-氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为:
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H
(g)+HCl(g)△H
在T℃时,向2.0L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见表:
下列有关说法正确的是( )
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H
(g)+HCl(g)△H在T℃时,向2.0L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见表:
| t/min | 0 | 1 | 2 | 5 | 10 |
| n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
| A. | 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol•L-1•min-1 | |
| B. | 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol•L-1,则反应的△H>0 | |
| C. | 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 molα-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行 | |
| D. | 在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20% |
11.丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中,正确的是( )
①新制氯水久置后→浅黄绿色消失
②氨气通入酚酞溶液中→红色
③蔗糖中加入浓硫酸搅拌→白色
④SO2通入品红溶液中→红色褪去.
①新制氯水久置后→浅黄绿色消失
②氨气通入酚酞溶液中→红色
③蔗糖中加入浓硫酸搅拌→白色
④SO2通入品红溶液中→红色褪去.
| A. | ①②③④ | B. | ②③④ | C. | ①②④ | D. | 全部 |
12.MO2受热分解为+4和+2价的混合氧化物,+4价的M能氧化浓盐酸生成Cl2,将1mol MO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3:2,则残余固体的组成及物质的量之比可能是( )
| A. | M3O4、MO 1:1 | B. | MO2、MO 3:1 | C. | M3O4、MO2 2:1 | D. | MO2、MO 1:4 |
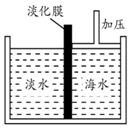 海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.
海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.