题目内容
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___、___(填标号)。
A.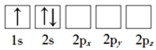
B.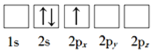
C.![]()
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是___。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子(AlH![]() )空间构型是___、中心原子的杂化形式为___。
)空间构型是___、中心原子的杂化形式为___。
(4)Li2O是离子晶体,其晶格能可通过如图的BornHaber循环计算得到。
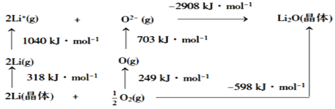
可知,Li原子的第一电离能为___kJ·mol1,O=O键键能为___kJ·mol1。
【答案】D C Li+核电荷数较大 正四面体 sp3 520 498
【解析】
(1)原子核外电子排布中,如果电子所占的轨道能级越高,该原子能量越高,激发态的原子比基态原子能量高,根据图知,电子排布能量最低的是D项的基态原子,能量最高的是处于激发态的C项对应的原子,故答案为:D;C;
(2)离子核电荷数:Li+>H-,其吸引电子能力:Li+>H-,导致其半径越小。故答案为:Li+核电荷数较大;
(3)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形、sp3杂化。故答案为:正四面体;sp3;
=4且不含孤电子对,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形、sp3杂化。故答案为:正四面体;sp3;
(4)Li原子的第一电离能为Li原子失去1个电子所需要的能量,所以其第一电离能为![]() kJ·mol-1=520kJ·mol-1;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ·mol-1=498kJ·mol-1。故答案为:520;498。
kJ·mol-1=520kJ·mol-1;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ·mol-1=498kJ·mol-1。故答案为:520;498。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
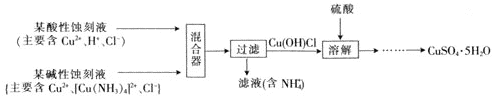
寒假天地重庆出版社系列答案【题目】如图表示的一些物质或概念之间的从属关系不正确的是( )
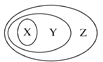
X | Y | Z | |
例 | 氧化物 | 化合物 | 纯净物 |
A | 含氧酸 | 酸 | 化合物 |
B | 溶液 | 分散系 | 混合物 |
C | 强电解质 | 电解质 | 化合物 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A. A B. B C. C D. D