题目内容
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 1mol•L-1的Na2CO3溶液中所含钠离子总数为2NA | |
| B. | 标准状况下,22.4L NO与足量O2充分反应,生成的NO2分子数为NA | |
| C. | 常温下,1mol SiC中含有Si-C键的数目为4NA | |
| D. | 常温常压下,33.6L 氯气与足量的铝充分反应,转移电子数为3NA |
分析 A、溶液体积不明确;
B、根据二氧化氮与四氧化二氮之间存在转化平衡分析;
C、在SiC中每个Si与四个C相连;
D、根据不是标准状况,则无法计算氯气的物质的量;
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、标准状况下,将22.4LNO的物质的量为1mol,11.2L氧气的物质的量为0.5mol,由于二氧化氮与四氧化二氮之间存在转化平衡,则生成的二氧化氮的物质的量小于1mol,其分子数小于NA,故B错误;
C、在SiC中每个Si与四个C相连,因此1mol SiC中含有Si-C键的物质的量为4mol,数目为4NA,故C正确;
D、33.6L氯气不是标准状况,则无法计算来确定反应中转移的电子数,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
19.下列各组物质性质的比较中,不正确的是( )
| A. | 热稳定性SiH4<PH3<NH3<H2O | B. | 熔点:Na>K>Rb>Cs | ||
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | D. | 半径:K+>Na+>O2->F- |
6.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球与蒸馏烧瓶支管口在同一高度处 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后,还需加少量蒸馏水再趁热过滤 | |
| D. | 除去混在苯中的苯酚时,可先加入饱和浓溴水,振荡后静置,再过滤 |
3.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测正确的是( )
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同族元素中Z的氢化物沸点最低 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
20.下列有关常见有机物的说法正确的是( )
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 提纯鸡蛋白中的蛋白质时,可向鸡蛋清溶液中加入浓硫酸铵溶液,然后将所得沉淀滤出,经洗涤即得到较纯净的蛋白质 | |
| D. | 石油分馏是化学变化,而煤的干馏为物理变化 |
1.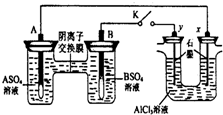 某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
 某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )| A. | 溶液中(A2+)浓度减小 | |
| B. | B 的电极反应:B-2eˉ═B2+ | |
| C. | y 电极上有 H2 产生,发生还原反应 | |
| D. | 反应初期,x 电极周围出现白色胶状沉淀,不久沉淀溶解 |
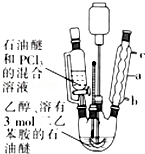 亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl
亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl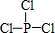 .
.
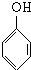 +nHCHO$\stackrel{催化剂}{→}$
+nHCHO$\stackrel{催化剂}{→}$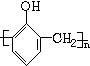 +nH2O.
+nH2O.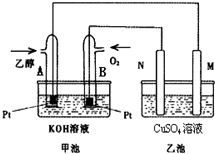 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.