题目内容
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知:800℃时CO(g)+H2O(g)?H2(g)+CO2(g)的初始浓度和平衡浓度如下表:
试回答下列问题:
(1)计算上述反应达平衡时的平衡常数及CO、H2O(g)的最大转化率.(要求书写过程 )
(2)若800℃不变,只改变水蒸气的初始浓度为4mol/L,求该条件下CO、H2O(g)的最大转化率.
(3)又知该反应在427℃时平衡常数为9.94,则上述逆向反应是: 反应(选填:放热、吸热)
(4)在800℃发生上述反应,以表中的量投入恒容反应容器中,其中向正反应方向移动的有 (选填A、B、C、D).
| 物质 | CO | H2O(g) | CO2 | H2 |
| 初始浓度/mol?L-1 | 1 | 1 | 0 | 0 |
| 平衡浓度/mol?L-1 | 0.5 | 0.5 | 0.5 | 0.5 |
(1)计算上述反应达平衡时的平衡常数及CO、H2O(g)的最大转化率.(要求书写过程 )
(2)若800℃不变,只改变水蒸气的初始浓度为4mol/L,求该条件下CO、H2O(g)的最大转化率.
(3)又知该反应在427℃时平衡常数为9.94,则上述逆向反应是:
(4)在800℃发生上述反应,以表中的量投入恒容反应容器中,其中向正反应方向移动的有
| A | B | C | D | |
| C(CO2) | 3 | 1 | 2 | 2 |
| C(H2) | 2 | 1 | 1 | 2 |
| C(CO) | 1 | 2 | 4 | 3 |
| C(H2O) | 5 | 2 | 0.5 | 1 |
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)平衡常数利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积,转化率=
×100%;
(2)依据平衡三段式和平衡常数计算;
(3)依据温度变化平衡常数变化,结合平衡移动原理分析平衡移动方向;
(4)计算浓度商Q和平衡常数比较分析判断反应进行的 方向;
| 消耗量 |
| 起始量 |
(2)依据平衡三段式和平衡常数计算;
(3)依据温度变化平衡常数变化,结合平衡移动原理分析平衡移动方向;
(4)计算浓度商Q和平衡常数比较分析判断反应进行的 方向;
解答:
解:(1)CO(g)+H2O(g)?H2(g)+CO2(g)反应 的平衡常数K=
=
=1;
CO、H2O(g)的最大转化率=
×100%=50%;
答:上述反应达平衡时的平衡常数为1,CO、H2O(g)的最大转化率50%;
(2)若800℃不变,只改变水蒸气的初始浓度为4mol/L,设一氧化碳转化的物质的量为x
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 1 4 0 0
变化量(mol/L) x x x x
平衡量(mol/L)1-x 4-x x x
K=
=1
x=0.8
求该条件下CO的最大转化率=
×100%=80%,H2O(g)最大转化率=
×100%=20%;
答:该条件下CO、H2O(g)的最大转化率分别为80%,20%;
(3)又知该反应在427℃时平衡常数为9.94,800°C平衡常数为1,随温度升高,平衡常数减小,平衡逆向进行,逆反应是吸热反应;
故答案为:吸热;
(4)A、Q=
=1.2>1,平衡逆向进行,故A不符合;
B、Q=
=0.5<1,平衡正向进行,故B符合;
C、Q=
=1=K,平衡不动,故C不符合;
D、Q=
=1.3>1,平衡逆向进行,故D不符合;
故选B.
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 0.5×0.5 |
| 0.5×0.5 |
CO、H2O(g)的最大转化率=
| 1-0.5 |
| 1 |
答:上述反应达平衡时的平衡常数为1,CO、H2O(g)的最大转化率50%;
(2)若800℃不变,只改变水蒸气的初始浓度为4mol/L,设一氧化碳转化的物质的量为x
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 1 4 0 0
变化量(mol/L) x x x x
平衡量(mol/L)1-x 4-x x x
K=
| x2 |
| (1-x)(4-x) |
x=0.8
求该条件下CO的最大转化率=
| 0.8mol/L |
| 1mol/L |
| 0.8mol/L |
| 4mol/L |
答:该条件下CO、H2O(g)的最大转化率分别为80%,20%;
(3)又知该反应在427℃时平衡常数为9.94,800°C平衡常数为1,随温度升高,平衡常数减小,平衡逆向进行,逆反应是吸热反应;
故答案为:吸热;
(4)A、Q=
| 3×2 |
| 1×5 |
B、Q=
| 1×1 |
| 2×2 |
C、Q=
| 2×1 |
| 4×0.5 |
D、Q=
| 2×2 |
| 3×1 |
故选B.
点评:本题考查了化学平衡常数概念分析计算,平衡常数和平衡三段式的计算应用,浓度商和平衡常数影响因素分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述中不正确的是( )
| A、标准状况下,22.4LCO和CO2混合气体中含有的碳原子数约为NA |
| B、1mol苯分子中含有的碳碳双键数为3NA |
| C、常温常压下,0.1mol铁在Cl2中充分燃烧,转移的电子数为0.3 NA |
| D、1L1mol/L的Na2CO3溶液中离子总数大于3NA |
下列有关仪器的使用正确的是( )
| A、用量筒量取22.50mL的浓硫酸 |
| B、滴定管的零刻度在上面,量筒的零刻度在下面,容量瓶没有零刻度 |
| C、酸式滴定管只能装酸性溶液,碱式滴定管只能装碱性溶液 |
| D、能用酒精灯加热的有:锥形瓶、烧杯、烧瓶、蒸发皿、坩埚 |
下列溶液一定呈碱性的是( )
| A、c(OH-)=1×10-6mol/L |
| B、c(OH-)>c(H+)的溶液 |
| C、能使甲基橙变黄的溶液 |
| D、含OH- 的溶液 |
下列有关化学用语的说法中正确的是( )
| A、次氯酸的结构式为:H-Cl-O |
B、-OH与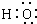 都表示羟基 都表示羟基 |
C、S2-的结构示意图:S2-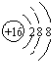 |
D、苯分子的球棍模型示意图: |
下列物质中,一氯代物种数最多的是( )
| A、邻二乙苯 |
| B、2-甲基-3-乙基戊烷 |
| C、乙苯 |
| D、1-甲基-3-乙基环己烷 |
下列说法中正确的是( )
| A、含有羟基的化合物一定属于醇类 |
| B、含有苯环的物质一定属于芳香化合物 |
| C、含有环状碳链的有机物都是脂环化合物 |
| D、分子中只含碳碳单键的烃都是烷烃 |
