题目内容
7.下列中心原子的杂化轨道类型和分子几何构型均不正确的是( )| A. | CCl4中C原子sp3杂化,为正四面体形 | |
| B. | BF3中B原子sp2杂化,为平面三角形 | |
| C. | CS2中C原子sp杂化,为直线形 | |
| D. | H2S分子中,S为sp杂化,为直线形 |
分析 首先判断中心原子形成的δ键数目,然后判断孤对电子数目,以此判断杂化类型,结合价层电子对互斥模型可判断分子的空间构型.
解答 解:A.CCl4中C原子形成4个δ键,孤对电子数为0,则为sp3杂化,为正四面体形,故A正确;
B.BF3中B原子形成3个δ键,孤对电子数为$\frac{3-3×1}{2}$=0,则为sp2杂化,为平面三角形,故B正确;
C.CS2中C原子形成2个δ键,孤对电子数为$\frac{4-2×2}{2}$=0,则为sp杂化,为直线形,故C正确;
D.H2S分子中,S原子形成2个δ键,孤对电子数为$\frac{6-2×1}{2}$=2,则为sp3杂化,为V形,故D错误.
故选D.
点评 本题考查原子杂化类型以及分子空间构型的判断,题目难度中等,本题注意把握杂化类型和空间构型的判断方法.

练习册系列答案
相关题目
18.用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA | |
| B. | 通常状况下,8g O2和O3 的混合气体含有的分子数是0.5NA | |
| C. | 常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA | |
| D. | 标准状况下,11.2L H2在氧气中完全燃烧后得到的产物的分子数为0.5NA |
2.下列化学变化中,物质发生还原反应的是( )
| A. | C→CO2 | B. | CO2→CO | C. | FeCl2→FeCl3 | D. | H2SO4→BaSO4 |
12.下列操作不正确的是( )
| A. | 实验室蒸馏石油时,将温度计的水银球插入液面下 | |
| B. | 稀释浓硫酸时,将浓硫酸沿玻璃棒慢慢注入盛有水的烧杯内并不断用玻璃棒搅拌 | |
| C. | 用蒸发皿蒸发液体时,未垫上石棉网直接加热蒸发皿 | |
| D. | 配制一定物质的量浓度的溶液时,清洗后未经干燥的容量瓶直接用于实验 |
19.下列有关氧化还原反应的叙述正确的是( )
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中所有元素的化合价都发生变化 | |
| C. | 任何一个置换反应一定属于氧化还原反应 | |
| D. | 没有单质参与的化合反应和没有单质生成的分解反应不可能是氧化还原反应 |
16.下列属于酸性氧化物的是( )
| A. | 一氧化碳 | B. | 过氧化钠 | C. | 氧化铝 | D. | 二氧化硫 |
11.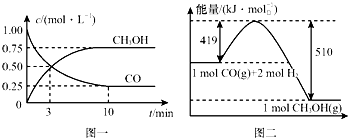 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系正确的是ADE.
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物 投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、 Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1 kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2 kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3 kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
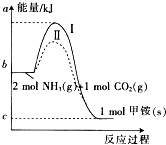 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如图所示.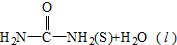 △H=+dkJ•mol-1,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为CO2(g)+2NH3(g)=
△H=+dkJ•mol-1,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为CO2(g)+2NH3(g)=