题目内容
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 在常温常压下,46g NO2和N2O4混合气体所含氧原子数目为2NA | |
| C. | 将1L 2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
分析 A、氦气为单原子分子;
B、NO2和N2O4的最简式均为NO2;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、标况下四氯化碳为液体.
解答 解:A、氦气为单原子分子,故含NA个氦原子的氦气的物质的量为1mol,在标况下为22.4L,故A错误;
B、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含氧原子为2NA个,故B正确;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故所得的氢氧化铁胶粒的个数小于2NA个,故C错误;
D、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
17.下列叙述正确的是( )
| A. | 氢氧化钠的摩尔质量是40 g | |
| B. | 1 mol NaOH的质量是40 g/mol | |
| C. | 1gH2和lgN2含分子数相等 | |
| D. | 等质量的N2、CH4、CO、H2O中,CH4含分子数最多 |
15.在容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g),有如图所示的关系曲线,根据下图下列判断正确的是( )
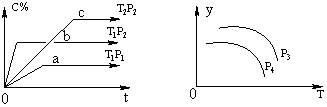

| A. | p3>p4,y轴表示A的物质的量分数 | |
| B. | 若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体 | |
| C. | p3<p4,y轴表示平衡常数K | |
| D. | p3>p4,y轴表示混合气体的平均摩尔质量 |
1. 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g);△H<0.
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g);△H<0.
(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
请回答下列问题:
①反应开始至达到平衡时,v(SOCl2)=0.005mol/(L•min).
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是使用催化剂.
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为2.6.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为B、E点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为243kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为2SOCl2+4e-=S+SO2↑+4Cl-,电解质中锂离子移向正极(填“正极”或“负极”).
 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g);△H<0.
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g);△H<0.(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①反应开始至达到平衡时,v(SOCl2)=0.005mol/(L•min).
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是使用催化剂.
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为2.6.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为B、E点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为243kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为2SOCl2+4e-=S+SO2↑+4Cl-,电解质中锂离子移向正极(填“正极”或“负极”).

 ;
;