题目内容
如表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号是 和 ;
(2)表中最活泼的金属元素是 ,非金属性最强的元素是 (用元素名称填写);
(3)用电子式表示⑥和⑨形成的化合物的过程
(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M的电子式 ,M中的化学键类型为 ;
(5)表中能形成两性氢氧化物的元素是 (用元素符号填写),写出该元素的氢氧化物与⑥的最高价氧化物对应水化物反应的离子方程式:
(6)元素⑦形成的单质的结构式为 实验室制取该单质的化学方程式是 .
| I A | IIA | ⅢA | IVA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属元素是
(3)用电子式表示⑥和⑨形成的化合物的过程
(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M的电子式
(5)表中能形成两性氢氧化物的元素是
(6)元素⑦形成的单质的结构式为
考点:位置结构性质的相互关系应用,元素周期律和元素周期表的综合应用
专题:
分析:由元素在周期表中的位置可知,①为N、②为F、③为Mg、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br,然后结合同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱及氢氧化铝是两性氢氧化物来解答.
解答:
解:由元素在周期表中的位置可知,①为N、②为F、③为Mg、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br,
(1)⑤和⑧的元素符号是Si、Ar,故答案为:Si;Ar;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中金属性最强的为K,非金属性最强的为F,
故答案为:K;F;
(3)⑥和⑨形成的化合物为K2S,用电子式表示形成过程为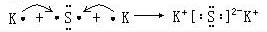 ,
,
故答案为: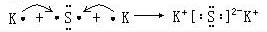 ;
;
(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M为NH4Cl,其电子式为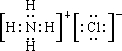 ,含离子键和共价键,
,含离子键和共价键,
故答案为: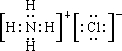 ;离子键和共价键;
;离子键和共价键;
(5)表中元素Al形成的氢氧化铝是两性氢氧化物;氢氧化铝与硫酸反应生成硫酸铝与水,离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:Al;Al(OH)3+3H+═Al3++3H2O;
(6)元素⑦形成的单质为Cl2,其结构式为Cl-Cl,实验室制取该单质的化学方程式是MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:Cl-Cl;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
(1)⑤和⑧的元素符号是Si、Ar,故答案为:Si;Ar;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中金属性最强的为K,非金属性最强的为F,
故答案为:K;F;
(3)⑥和⑨形成的化合物为K2S,用电子式表示形成过程为
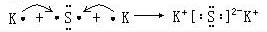 ,
,故答案为:
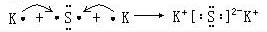 ;
;(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M为NH4Cl,其电子式为
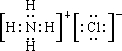 ,含离子键和共价键,
,含离子键和共价键,故答案为:
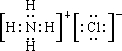 ;离子键和共价键;
;离子键和共价键;(5)表中元素Al形成的氢氧化铝是两性氢氧化物;氢氧化铝与硫酸反应生成硫酸铝与水,离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:Al;Al(OH)3+3H+═Al3++3H2O;
(6)元素⑦形成的单质为Cl2,其结构式为Cl-Cl,实验室制取该单质的化学方程式是MnO2+4HCl(浓)
| ||
故答案为:Cl-Cl;MnO2+4HCl(浓)
| ||
点评:本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
下列措施对增大反应速率明显有效的是( )
| A、Na与水反应时增大水的用量 |
| B、Fe与稀硫酸反应制取H2时,增大压强 |
| C、用H2O2制取O2的实验中,改用2倍浓度的H2O2 |
| D、Al在氧气中燃烧生成A1203,将Al片改成Al粉 |
下列离子方程式书写正确的是( )
| A、向漂白粉溶液中通入少量SO2气体:Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl- |
| B、向盐酸中逐滴加入等体积等浓度的碳酸钠溶液:CO32-+2H+═CO2↑+H2O |
| C、KHC2O4使酸性KMnO4溶液褪色:5C2O42-+16H++2MnO4-═10CO2↑+2Mn2++8H2O |
| D、向银氨溶液中加入足量的氢碘酸溶液:〔Ag(NH3)2〕++OH-+3H+═Ag++H2O+2NH4+ |
 与足量的NaOH溶液反应,消耗NaOH的物质的量为( )
与足量的NaOH溶液反应,消耗NaOH的物质的量为( )| A、5mol | B、4mol |
| C、3mol | D、2mol |