题目内容
有一包白色固体混合物,可能由Na2CO3、K2SO4、BaCl2、NaCl中的几种混合而成.对此混合物进行以下实验:
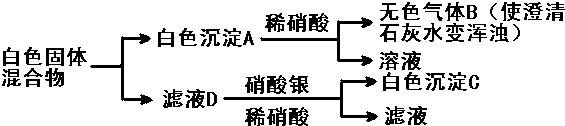
(1)书写下列物质的化学式:
A ,B ,C .
(2)白色固体混合物中一定含有 ,一定不含有 ,可能含有 .
(3)写出下列反应的离子方程式:
(1)混合物溶于水生成白色沉淀A ;
(2)A与稀硝酸的反应 ;
(3)滤液D与硝酸银溶液的反应 .

(1)书写下列物质的化学式:
A
(2)白色固体混合物中一定含有
(3)写出下列反应的离子方程式:
(1)混合物溶于水生成白色沉淀A
(2)A与稀硝酸的反应
(3)滤液D与硝酸银溶液的反应
考点:无机物的推断
专题:物质检验鉴别题
分析:混合物溶于水,生成白色沉淀,因为沉淀与硝酸反应生成气体B,则A为BaCO3,原混合物一定含Na2CO3、BaCl2,一定不含K2SO4,滤液D加硝酸银生成白色沉淀C为AgCl,不能确定是否含NaCl,以此来解答.
解答:
解:混合物溶于水,生成白色沉淀,因为沉淀与硝酸反应生成气体B为CO2,则A为BaCO3,原混合物一定含Na2CO3、BaCl2,一定不含K2SO4,滤液D加硝酸银生成白色沉淀C为AgCl,不能确定是否含NaCl,
(1)由上述分析可知,A、B、C分别为BaCO3、CO2、AgCl,故答案为:BaCO3;CO2;AgCl;
(2)白色固体混合物中一定含有Na2CO3、BaCl2,则一定不会含有K2SO4,可能含有NaCl,故答案为:Na2CO3、BaCl2;K2SO4;NaCl;
(3)①混合物溶于水生成白色沉淀A的离子方程式为:CO32-+Ba2+=BaCO3↓,故答案为:CO32-+Ba2+=BaCO3↓;
②BaCO3溶于稀硝酸的反应为:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
③滤液D中含有氯离子,与硝酸银溶液的反应是:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓.
(1)由上述分析可知,A、B、C分别为BaCO3、CO2、AgCl,故答案为:BaCO3;CO2;AgCl;
(2)白色固体混合物中一定含有Na2CO3、BaCl2,则一定不会含有K2SO4,可能含有NaCl,故答案为:Na2CO3、BaCl2;K2SO4;NaCl;
(3)①混合物溶于水生成白色沉淀A的离子方程式为:CO32-+Ba2+=BaCO3↓,故答案为:CO32-+Ba2+=BaCO3↓;
②BaCO3溶于稀硝酸的反应为:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
③滤液D中含有氯离子,与硝酸银溶液的反应是:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓.
点评:本题考查物质的推断及鉴别,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
相关题目
下列说法中,不正确的是( )
| A、分液操作时,分液漏斗下端管口尖端处紧靠烧杯内壁 |
| B、利用丁达尔效应可鉴别溶液和胶体 |
| C、二氧化硅能用于制造光导纤维 |
| D、用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸 |
下列水溶液的浓度均为0.1mol.L-1,其中溶液pH最小的是( )
| A、Na2CO3溶液 |
| B、NaOH溶液 |
| C、NaHSO4溶液 |
| D、NH4Cl溶液 |
除去FeCl2溶液中少量的氯化铁,可行的办法是( )
| A、加铁粉 |
| B、通Cl2 |
| C、加铜粉 |
| D、滴入KSCN溶液 |
下列四种化合物:①碳酸氢钠 ②氯化铵 ③偏铝酸钠 ④氢氧化铝,既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
| A、① | B、②③ | C、②③④ | D、①④ |
把①蔗糖、②麦芽糖、③纤维素、④淀粉、⑤蛋白质在稀硫酸存在下分别进行水解,最终产物只有1种的是( )
| A、①和② | B、只有②③④ |
| C、只有③ | D、只有④ |