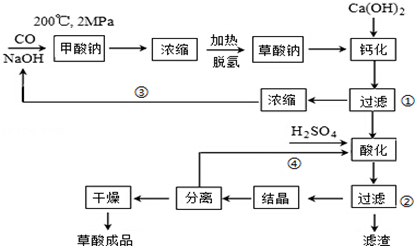
��Ŀ����
12�����绷�����˽���ȫ���ֹʹ��������������ˮ����������������ø�Ч����ɫ���������������ȣ�����������һ�ּ��ױ�ը��ǿ���������壬������ˮ�����ȶ����ʻ���ɫ����������ʹ��ʱ���뾡����ϡ���������ϡ�ͣ�ͬʱ��Ҫ������ա�����ȣ�ʵ�����Ե�ⷨ�Ʊ�ClO2���������£�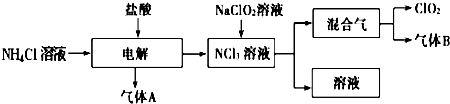
��1��ClO2������ԭ�Ӳ��ǣ���ǡ����ǡ���������8���ӽṹ����ͼ��ʾ��ⷨ�ƵõIJ�������������B��ʹʯ����Һ����ɫ����ȥ���������ѡ��C��
A������ʳ��ˮ�� B����ʯ�ҡ� C��Ũ���ᡡ D������ˮ
��2���ȶ��Զ���������Ϊ�ƹ�������ȶ����������Ͳ�Ʒ������˵����ȷ����ABCD��
A���������ȿɹ㷺���ڹ�ҵ������ˮ����
B��Ӧ����ʳƷ��ҵ������Ч���ӳ�ʳƷ������
C���ȶ��Զ������ȵij��ִ�������˶������ȵ�ʹ�÷�Χ
D���ڹ������ͳ�Ʒ�������ڣ�Ҫ��ͨ��װ�úͼ�⼰����װ��
��3��ŷ������Ҫ��������������Ũ�����Ʊ�����ѧ��Ӧ����ʽΪ2NaClO3+4HCl��Ũ���T2NaCl+Cl2��+2ClO2��+2H2O��ȱ����Ҫ�Dz��ʵ͡���Ʒ���Է��룬��������Ⱦ������
��4���ҹ��㷺���þ��������ϡ�͵�����������������ƣ�NaClO2����Ӧ�Ʊ�����ѧ����ʽ��2NaClO2+Cl2�T2NaCl+2ClO2���˷����ŷ�������ŵ��ǰ�ȫ�Ժã�û�в���������Ʒ��
��5����ѧ�����о�����һ���µ��Ʊ����������������ữ�IJ��ᣨH2C2O4����Һ��ԭ�����ƣ���ѧ��Ӧ����ʽΪH2C2O4+2NaClO3+H2SO4�TNa2SO4+2CO2��+2ClO2��+2H2O���˷���������������桢����İ�ȫ�ԣ�ԭ���Ƿ�Ӧ���������ɵĶ�����̼��ϡ�����ã�
���� NH4Cl��Һ�м���������е��õ�NCl3�����NԪ�ػ��ϼ����ߣ���֪��Ԫ�ػ��ϼ۽��ͣ������ɵ�����AΪH2��NCl3��Һ�м���NaClO2��Һ���õ�ClO2������B������B��ʹʪ��ĺ�ɫʯ����ֽ��������BΪNH3��
��1��Cl�����7�����ӣ�ֻ��1�������ӣ�O�����6�����ӣ���2�������ӣ���������������B��ʹʯ����Һ����ɫ��Ϊ��������ѡ�������ӣ�
��2��������ɣ�����������һ�ּ��ױ�ը��ǿ���������壬������ˮ�����ȶ����ʻ���ɫ����������ʹ��ʱ���뾡����ϡ���������ϡ�ͣ�ͬʱ��Ҫ������ա�����ȣ��ݴ˽��
��3������������Ũ�������ɶ������ȡ��Ȼ��ơ�ˮ��������
��4������������������Ʒ���������ԭ��Ӧ���ɶ������Ⱥ��Ȼ��ƣ�����������ԭ��Ӧ���ԭ�Ӹ����غ������д����ʽ�����ݲ��������ж����ŵ㣻
��5���������ữ�IJ��ᣨH2C2O4����Һ��ԭ�����ƣ���Ӧ���������ơ�������̼���������ȡ�ˮ���Դ������
��� �⣺NH4Cl��Һ�м���������е��õ�NCl3�����NԪ�ػ��ϼ����ߣ���֪��Ԫ�ػ��ϼ۽��ͣ������ɵ�����AΪH2��NCl3��Һ�м���NaClO2��Һ���õ�ClO2������B������B��ʹʪ��ĺ�ɫʯ����ֽ��������BΪNH3��
��1��Cl�����7�����ӣ�ֻ��1�������ӣ�O�����6�����ӣ���2�������ӣ���Oԭ�Ӳ�������8�����ȶ��ṹ����������������B��ʹʯ����Һ����ɫ��Ϊ��������ѡ�������ӣ�ֻ��C��Ũ������ϣ�
�ʴ�Ϊ�����ǣ�C��
��2��A���������Ⱦ���ǿ�������ԣ��������ȿɹ㷺���ڹ�ҵ������ˮ����������������Ϊ����ɫ������������A��ȷ��
B������������ɱ����������Ч���ӳ�ʳƷ�����ڣ���B��ȷ��
C���ȶ��Զ������ȵij��ִ�������˶������ȵ�ʹ�÷�Χ�����������Ӧ�ã���C��ȷ��
D������������һ�ּ��ױ�ը��ǿ���������壬�ڹ������ͳ�Ʒ�������ڣ�Ҫ��ͨ��װ�úͼ�⼰����װ����D��ȷ��
��ѡ��A��B��C��D��
��3������������Ũ�������ɶ������ȡ��Ȼ��ơ�ˮ����������Ӧ�Ļ�ѧ����ʽ��2NaClO3+4HCl��Ũ���T2NaCl+Cl2��+2ClO2��+2H2O��
�ʴ�Ϊ��2NaClO3+4HCl��Ũ���T2NaCl+Cl2��+2ClO2��+2H2O��
��4������������������Ʒ���������ԭ��Ӧ���ɶ������Ⱥ��Ȼ��ƣ�����������ԭ��Ӧ���ԭ�Ӹ����غ㣬��Ӧ�ķ���ʽ��2NaClO2+Cl2�T2NaCl+2ClO2���÷����ŷ�������ŵ�Ϊ��ȫ�Ժã�û�в���������Ʒ��
�ʴ�Ϊ��2NaClO2+Cl2�T2NaCl+2ClO2����ȫ�Ժã�û�в���������Ʒ��
��5���������ữ�IJ��ᣨH2C2O4����Һ��ԭ�����ƣ���Ӧ���������ơ�������̼���������ȡ�ˮ���÷�ӦΪH2C2O4+2NaClO3+H2SO4�TNa2SO4+2CO2��+2ClO2��+2H2O���˷���������������桢����İ�ȫ�ԣ�ԭ���Ƿ�Ӧ���������ɵĶ�����̼��ϡ�����ã�
�ʴ�Ϊ��H2C2O4+2NaClO3+H2SO4�TNa2SO4+2CO2��+2ClO2��+2H2O����Ӧ���������ɵĶ�����̼��ϡ�����ã�
���� ���⿼��������ȵ��Ʊ������ʼ�Ӧ�ã�ȷ������ɸ�����Ϣ����Ϥ������ԭ��Ӧ���������ǽ���ؼ�����Ŀ�ѶȽϴ�

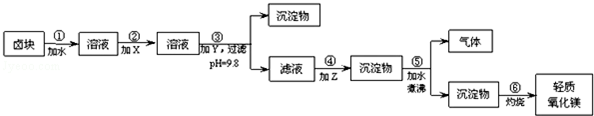
��Ҫ���Ʒ�����������ʣ����������ɱ��ϵͣ������������ϣ���д�հף�
��֪����1��25�棬Ksp[Fe��OH��3]=4.0��10-38��Ksp[Fe��OH��2]=8.0��10-16��
Ksp[Mg��OH��2]=1.8��10-11��Ksp[Mn��OH��2]=4.0��10-14��
��2��Fe2+�����������״�����״���Һ�г�ȥ������������ΪFe3+������Fe��OH��3������ȥ
��3��ԭ�ϼ۸��
| ���� | �۸�/Ԫ•��-1 |
| ƯҺ����25.2%NaClO�� | 450 |
| ˫��ˮ����30%H2O2�� | 2400 |
| �ռ��98%NaOH�� | 2100 |
| �����99.5%Na2CO3�� | 600 |
��2���ڲ�����м�����Լ�X����ѵ�ѡ����ƯҺ��NaClO��
��3���ڲ�����м�����Լ�YӦ���ռNaOH����������з����ķ�Ӧ��MgCO3+H2O$\frac{\underline{\;���\;}}{\;}$Mg��OH��2+CO2��
��4�����������ʵ���ҽ��У�Ӧѡ�������������������ƣ������գ�
��5��25�棬��±���Ӧ��ˮ��Һ�У�����һ�������ռ�ﵽ������Һƽ�⣬���pH=4.00������¶��²�������Һ�е�c��Fe3+��=4��10-8mol/L��
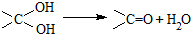 �����
���л���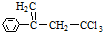 ��ѡ�������������Գ��ݼ����׳ư�ϩ����Ҫ����ˮ��������ݣ������йظ��л����˵��������ǣ�������
��ѡ�������������Գ��ݼ����׳ư�ϩ����Ҫ����ˮ��������ݣ������йظ��л����˵��������ǣ�������| A�� | ��ʹ���Ը��������Һ��ɫ | |
| B�� | ���� ��Cl2�ڹ���������ͨ��ȡ����Ӧ��ýϴ��ĸ����� ��Cl2�ڹ���������ͨ��ȡ����Ӧ��ýϴ��ĸ����� | |
| C�� | �ڼ��������³��ˮ�⣬������������ | |
| D�� | ��һ�������¿ɷ����ۺϷ�Ӧ |
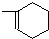
��1�������ѵĺ˴Ź�������ͼ����1�����շ壬�������������Ѽ���
��2�������ѵ�ͬ���칹��A��Ũ�����ϣ����ȵ�170��ʱ�����л���B��
��д��A�Ĺ����ŵ���ʽΪ
 ��B����ˮ��Ӧ���ɵ���������Ϊ1��2-�������飻
��B����ˮ��Ӧ���ɵ���������Ϊ1��2-�������飻�ڵ¹���ѧ�ҵڶ�˹������ѧ���������״η��ֺͼ���һ�����ͷ�Ӧ�����1950��ŵ������ѧ�����÷�Ӧ��һ�ֻ��ӳɷ�Ӧ��������˫���������IJ����ͻ�������Ժ���״��״������˫ϩ��ϵ����1��4�ӳɷ�Ӧ��ͨ������һ����Ԫ�����÷�Ӧ�����ºͣ����ʺܸߣ����л���ѧ�ϳɷ�Ӧ�зdz���Ҫ��̼̼���γɵ��ֶ�֮һ��Ҳ���ִ��л��ϳ��ﳣ�õķ�Ӧ֮һ�����������Ϣд��2-��-1��3-����ϩ��������˫ϩ��ϵ����B��Ӧ��ѧ����ʽCH2=C��CH3��CH=CH2+CH2=CH2
 ��
����3�������ѡ�����������������Һ�����ʯī�缫����ȼ�ϵ�أ����缫��Ӧʽ��CH3OCH3+16OH--12e-=2CO32-+11H2O��
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ�ȣ�mol•L-1�� | 0.44 | 0.60 | 0.60 |
�ٱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v�������� v���棩�����������������=������
������ʼֻ����CH3OH����10min��Ӧ�ﵽƽ�⣬����ﵽƽ��ʱCH3OHת���� ����CH3OH��=96.8%���������ðٷ�����ʾ������С����һλ����
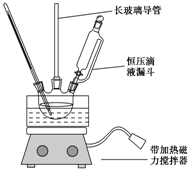 ����������Ҫ�Ļ���ԭ�ϣ���;�㷺��ʵ��������ͼװ���Ʊ����������������£�
����������Ҫ�Ļ���ԭ�ϣ���;�㷺��ʵ��������ͼװ���Ʊ����������������£���ȡ100mL�ձ�����20mLŨ������18mLŨ�������ƻ���ᣬ�����ѹ��Һ©���У���18mL������������ƿ�У�
���������µı�����μ�����ᣬ�ߵα߽��裬��;��ȣ�
����50��60���·�����Ӧ��ֱ����Ӧ������
�ܷ�������������������ˮ��100mL 0.1mol/L��Na2CO3��Һϴ�ӣ������������ˮϴ�ӵõ��ֲ�Ʒ��
����ֲ�Ʒ�������D��ȥˮ��Ȼ�����õ���������������
�����õ����й������б�����
| ��� | �۵�/�� | �е�/�� | �ܶȣ�20�棩/g•cm-3 | �ܽ��� |
| �� | 5.5 | 80 | 0.88 | ����ˮ |
| ������ | 5.7 | 210.9 | 1.205 | ������ˮ |
| Ũ���� | - | 83 | 1.4 | ������ˮ |
| Ũ���� | - | 338 | 1.84 | ������ˮ |
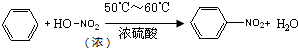 ��
����2�����ƻ���Ӧ���ձ����ȼ���Ũ���ᣬ��������������������������ѹ��Һ©�����ŵ���ʹ�������˳�����£�
��3����Ӧ�¶ȿ�����50��60���ԭ���Ƿ�ֹ����Ӧ��������Ӧ������������²㣨��ϡ����ߡ��¡������������Ͳ�Ʒ�IJ��������Ƿ�Һ��
��4��ʵ��ǰҪ����100mL 0.1mol/L��Na2CO3��Һ����Ҫ�õ��IJ����������˲��������ձ�����100ml����ƿ����ͷ�ιܣ�
��5����Na2CO3��Һϴ��֮����������ˮϴ��ʱ��������֤Һ����ϴ����ȡ���һ��ϴ��Һ������Һ�м����Ȼ��ƣ��������ɣ�˵����ϴ����
��6������D������Ϊ��ˮ�Ȼ��ƣ�
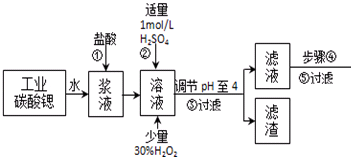
��֪����SrCl2•6H2O������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��
���й��������↑ʼ��������ȫ������pH����
| �������� | Fe��OH��3 | Fe��OH��2 |
| ��ʼ������pH | 1.5 | 6.5 |
| ������ȫ��pH | 3.7 | 9.7 |
��2�����������£�����30% H2O2��Һ����Fe2+������Fe3+�������ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O��
��3���ڲ����-�۵Ĺ����У�����Һ��pHֵ��1������4ʱ�����õ��Լ�ΪB��
A����ˮ B���������ȷ�ĩ C�� �������� D��̼���ƾ���
��4����������������������Ҫ�ɷ���Fe��OH��3��BaSO4 ���ѧʽ����
��5����ҵ����ɲ����۳��õ��豸�У�B
A������ B ���Ļ� C �Ƚ����� D ��Ӧ��
��6����ҵ�����ȷ紵����ˮ�Ȼ��ȣ����˵��¶���B
A��40��50��B��50��60��C��60��70��D��80�����ϣ�
��7����֪��ҵ�������ȵ�������Ϊ90%�����������ݼ��㹤ҵ̼���ȵĴ��ȣ�$\frac{1480a}{267W��9}$��100%��
 ��ͼ��һ���绯ѧ����ʾ��ͼ��
��ͼ��һ���绯ѧ����ʾ��ͼ��