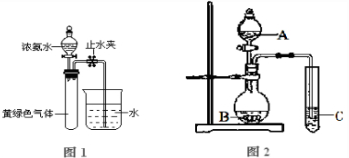
题目内容
| |||||||||||||||||||||||||||||||
答案:1.ABCD;2.C;
解析:
解析:
(1) |
根据所给化学方程式可知, NO和NO2的混合气体中只要V(NO2)≥V(NO),混合气体即可被过量NaOH溶液完全吸收,因此B、D选项均符合题意.A选项可以发生的反应是4NO+O2+2H2O |
(2) |
用极端假设法.若原混合气体中无 NO2,根据4NO+3O2+2H2O |
(3) |
答案: Cu++NO2-+2H+提示: NO2-转变为NO,氮无素的化合价降低,根据氧化还原反应原理,Cu+应该被氧化成Cu2+. |

练习册系列答案
相关题目