题目内容
以下变化中加入还原剂才能发生的是( )
| A、MnO4-→Mn2+ |
| B、HCl→Cl2 |
| C、Fe→Fe3+ |
| D、SO32-→SO2 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:需要加入还原剂才能实现,说明给予物质作氧化剂,在反应中得电子化合价降低,据此分析解答.
解答:
解:需要加入还原剂才能实现,说明给予物质作氧化剂,在反应中得电子化合价降低,
A.该反应中Mn元素化合价由+7价变为+2价,所以高锰酸根离子作氧化剂,需要加入还原剂才能实现,如浓盐酸等,故A正确;
B.该反应中Cl元素化合价由-1价变为0价,所以HCl作还原剂,需要加入氧化剂才能实现,如二氧化锰,故B错误;
C.该反应中Fe元素化合价由0价变为+3价,需要加入氧化剂才能实现,如氯气、硝酸等,故C错误;
D.该反应中各元素化合价不变,所以不发生氧化还原反应,故D错误;
故选A.
A.该反应中Mn元素化合价由+7价变为+2价,所以高锰酸根离子作氧化剂,需要加入还原剂才能实现,如浓盐酸等,故A正确;
B.该反应中Cl元素化合价由-1价变为0价,所以HCl作还原剂,需要加入氧化剂才能实现,如二氧化锰,故B错误;
C.该反应中Fe元素化合价由0价变为+3价,需要加入氧化剂才能实现,如氯气、硝酸等,故C错误;
D.该反应中各元素化合价不变,所以不发生氧化还原反应,故D错误;
故选A.
点评:本题考查氧化还原反应,侧重考查基本概念,根据元素化合价变化分析即可,注意氧化还原反应本质和特征的区别,熟练常见元素化合价.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
相同质量的钠在下列情况下产生氢气最多的是( )
| A、投入到足量水中 |
| B、投入到足量盐酸中 |
| C、投入到足量CuSO4溶液中 |
| D、用刺有小孔的铝箔包好放入足量水中 |
下列说法正确的是( )
| A、垃圾处理常用的方法是卫生填埋、堆肥和焚烧 |
| B、将垃圾分类并回收是处理的发展方向 |
| C、填埋垃圾不需要治理,只需深埋即可 |
| D、垃圾是污染物,不会产生二次污染 |
照反应Br+H2?HBr+H的能量变化示意图,下列叙述正确的是( )
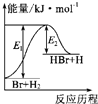

| A、该反应的△H=+(E1-E2)kJ?mol-1 |
| B、加入催化剂,该化学反应的反应热变大 |
| C、反应物的总能量高于生成物的总能量 |
| D、该反应为放热反应 |
根据下列反应,判断氧化性强弱正确的是( )
①2H2S+O2═2S↓+2H2O ②4NaI+O2+2H2O═4NaOH+2I2 ③Na2S+I2═2NaI+S↓
①2H2S+O2═2S↓+2H2O ②4NaI+O2+2H2O═4NaOH+2I2 ③Na2S+I2═2NaI+S↓
| A、O2>I2>S |
| B、O2>S>I2 |
| C、I2>O2>S |
| D、S>I2>O2 |
设阿伏加德罗常数为NA,则下列说法正确的是( )
| A、15g甲基(-CH3)所含有的电子数是10NA | ||
| B、0.5mol 1,3一丁二烯分子中含有的碳碳双键数为NA | ||
C、标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为
| ||
| D、60gSiO2晶体中,含有NA个Si-O键 |
高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是( )
| A、制高铁酸钾用 KClO做还原剂 |
| B、Fe(OH)3是还原剂 |
| C、高铁酸钾中铁的化合价为+7 |
| D、制备高铁酸钾时1 molFe(OH)3得到3 mol电子 |
 如图所示X、Y分别为直流电源的两极,Z溶液可能为:①稀硫酸 ②NaOH溶液 ③Na2SO4 溶液 ④CuCl2 溶液 ⑤NaCl溶液 ⑥稀盐酸 ⑦CuSO4 溶液
如图所示X、Y分别为直流电源的两极,Z溶液可能为:①稀硫酸 ②NaOH溶液 ③Na2SO4 溶液 ④CuCl2 溶液 ⑤NaCl溶液 ⑥稀盐酸 ⑦CuSO4 溶液