题目内容
1.(1)工业上制粗硅的主要化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)三大传统无机非金属材料是玻璃、陶瓷和水泥.
(3)向硅酸钠水溶液中通入少量二氧化碳的离子方程式H2O+CO2+SiO32-=CO32-+H2SiO3↓.
(4)关于 As 的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O 和一种 未知物质 X.
①已知 KBrO3 在反应中得到电子,则该反应的还原剂是AsH3.
②已知 0.2mol KBrO3 在反应中得到 1mol 电子生成 X,则 X 的化学式为Br2.
③在该反应中,氧化剂与还原剂的物质的量之比为8:5.
(5)容量瓶上需标有以下五项中的 ACE
A.温度B.浓度C.规格D.压强E.刻度线.
分析 (1)工业上制粗硅为碳还原二氧化硅生成硅和一氧化碳;
(2)三大传统无机非金属材料是玻璃、陶瓷和水泥;
(3)向硅酸钠水溶液中通入少量二氧化碳发生反应生成碳酸钠和硅酸沉淀;
(4)①KBrO3在反应中得到电子,则Br元素的化合价降低,给出的物质中AsH3具有还原性,As元素的化合价在反应中升高;
②由元素化合价的变化来计算转移的电子;
③根据化合价的升降判断氧化剂和还原剂,根据得失电子守恒计算之比;
(5)容量瓶上需标有温度、规格和刻度线.
解答 解:(1)工业上制粗硅为碳还原二氧化硅生成硅和一氧化碳,发生化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)三大传统无机非金属材料是玻璃、陶瓷和水泥,故答案为:玻璃、陶瓷和水泥;
(3)向硅酸钠水溶液中通入少量二氧化碳发生反应生成碳酸钠和硅酸沉淀,离子方程式为:H2O+CO2+SiO32-=CO32-+H2SiO3↓,
故答案为:H2O+CO2+SiO32-=CO32-+H2SiO3↓.
(4)①KBrO3在反应中得到电子,则Br元素的化合价降低,给出的物质中AsH3具有还原性,As元素的化合价在反应中升高,故答案为:AsH3;
②设X中Br元素化合价为x,由元素化合价的变化可知转移的电子为0.2mol×(5-x)=1mol,解得x=0,则X为Br2,故答案为:Br2;
③KBrO3在反应中生成Br2得到5个电子为氧化剂,AsH3在反应中生成H3AsO4失去8个电子为还原剂,转移的电子数为40e-,则根据得失电子相等,氧化剂与还原剂的物质的量之比为8:5,故答案为:8:5;
(5)容量瓶上需标有温度、规格和刻度线,故选:ACE.
点评 本题考查硅及其化合物的性质以及氧化还原反应,明确元素的化合价是解答本题的关键,注意利用氧化还原反应中的规律及表示方法来解答即可,难度不大.

①

②

③CH3OH
④

⑤

⑥

| A. | ①④⑤ | B. | ②④ | C. | ②⑥ | D. | ①②⑥ |
| A. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| B. | 氢氧化铝具有弱碱性,是医用中常见的胃酸中和剂 | |
| C. | 亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 | |
| D. | 液氨气化时要吸收大量的热,使周围温度降低,因而液氨可作制冷剂 |
| 气体发生装置 | 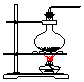 a | 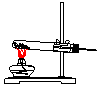 b |  c |
| 气体收集装置 |  2 | 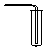 ② | 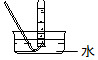 ③ |
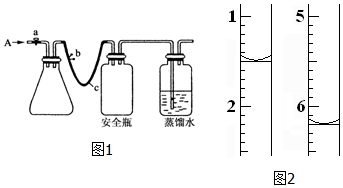
(1)从图中选择实验室制取氨气的发生装置b(选填编号)、收集装置①(选填编号).
(2)用注射器收集50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后注射器内无(选填“有”“无”)气体剩余,液体呈红色,用化学方程式解释液体颜色变化的原因NH3+H2O?NH3•H2O?NH4++OH-.
(3)工业合成氨的简易流程如图:
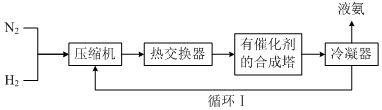
通过循环Ⅰ可利用的气态物质是d
a.催化剂 b.只有N2c.只有H2 d.N2和H2
(4)将 CO2通入到氨化的饱和食盐水中制备NaHCO3固体,反应的化学方程式NaCl+CO2+NH3+H2O→NaHCO3↓+NH4Cl.29NH3、PH3、
AsH3三种氢化物热稳定性由强到弱的顺序是NH3>PH3>AsH3,理由是N、P、As原子半径依次增大,使得N-H、P-H、As-H键长依次增长,热稳定性逐渐减弱.
(5)工业上用氨水吸收SO2尾气,最终得到化肥 (NH4)2SO4.(NH4)2SO4溶液呈酸性,用离子方程式解释原因NH4++H2O=NH3•H2O+H+;该溶液中存在多种守恒,用离子浓度表示其中一种守恒关系电荷守恒为:[NH4+]+[H+]=2[SO42-]+[OH-]或者物料守恒为:2[SO42-]=[NH4+]+[NH3•H2O].
| A. | 通过石油的裂解可以获得更多的汽油 | |
| B. | 蛋白质、纤维素、油脂、聚乙烯、淀粉都是高分子化合物 | |
| C. | 研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 | |
| D. | 石油、煤、天然气、植物油都属于化石燃料 |
| A. | 同温同压下,具有相同数目分子的气体必具有相同的体积 | |
| B. | 等质量的O2和H2的物质的量之比为16:1 | |
| C. | 不同的气体若体积不等,则它们所含的分子数一定不等 | |
| D. | 同温同体积下,两种气体的物质的量之比等于密度之比 |
| A. | HCN易溶于水 | |
| B. | 氢氰酸溶液可以使pH试纸变红 | |
| C. | NaCN溶液显碱性 | |
| D. | 等物质的量的HCN与NaOH恰好完全反应 |